根据下列反应判断有关物质还原性由强到弱的顺序是
H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3 =2FeCl3+NO↑+2H2O+Fe(NO3)3
| A.H2SO3>I->Fe2+>NO |
| B.I->Fe2+>H2SO3>NO |
| C.Fe2+>I->H2SO3>NO |
| D.NO>Fe2+>H2SO3>I- |
下列有关热化学方程式的叙述正确的是
| A.反应物的总能量高于生成物的总能量时,该反应常温下即可发生 |
| B.氢气燃烧热为285.8kJ·mol-1,则有H2(g)+1/2O2(g)=H2O(g) △H=-285.8kJ·mol-1 |
| C.将1molBa(OH)2的稀溶液与稀盐酸完全中和,放出114.6kJ的热量,热化学方程式为:OH-(aq)+H+(aq)=H2O(l) △H =-114.6kJ·mol-1 |
D.2SO2(g)+O2(g)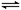 2SO3 (g);△H=-QkJ·mol-1(Q>0),则将2molSO2(g)和足量O2置于一密闭容器中,充分反应后放出的热量一定小于QkJ 2SO3 (g);△H=-QkJ·mol-1(Q>0),则将2molSO2(g)和足量O2置于一密闭容器中,充分反应后放出的热量一定小于QkJ |
相同材质的铁在图中的四种情况下最不易被腐蚀的是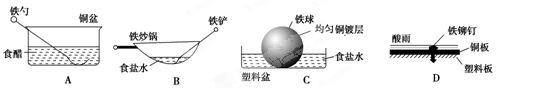
25℃时,水的电离达到平衡:H2O H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
| A.向水中加入稀醋酸,平衡逆移,c(H+)降低 |
| B.将水加热,KW增大,pH不变 |
| C.向水中加入少量固体硫酸氢钾,c(H+)增大,KW不变 |
| D.pH=10的NaOH溶液与pH=10的NaClO溶液中,水电离c(H+)之比等于106 |
下列有机物①CH2=CH2;②CH3CH2Br;③C2H5OH;④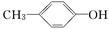 ;⑤CCl4;
;⑤CCl4;
⑥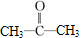 ;⑦
;⑦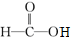 ;⑧
;⑧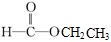 据官能团的不同可分为
据官能团的不同可分为
| A.5类 | B.6类 | C.7类 | D.8类 |
下列关于原电池和电解池的说法正确的是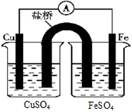
| A.如图所示,把盐桥换为铜导线也可以形成原电池 |
| B.电解饱和食盐水制烧碱,用碳钢网作阳极 |
| C.白铁是在铁上电镀锌,用锌作阳极,铁作阴极 |
| D.电解法精炼粗铜时,电解质溶液CuSO4溶液浓度不变 |