分别将下列物质:①CuSO4 ②Na2O2 ③NaCl ④Ca(HCO3)2 ⑤FeCl3投入水中,对其溶液加热蒸干,仍能得到原物质的是 ( )
| A.①②③ | B.①③ | C.③④ | D.③ |
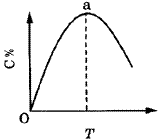
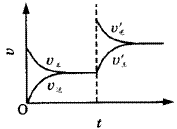
图1表示mA(g)+nB(g) pC(g)+qD(g)+Q,在不同温度下经过一定时间混合体系中C的质量分数与温度T的关系;图2表示在一定条件下达到平衡(v正=v逆)后t时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,判断该反应是( )。
pC(g)+qD(g)+Q,在不同温度下经过一定时间混合体系中C的质量分数与温度T的关系;图2表示在一定条件下达到平衡(v正=v逆)后t时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,判断该反应是( )。
 |
 |
| 图1曲线图 |
图2曲线图 |
| A.m+n>p+qQ>0 |
| B.m+n>p+qQ<0 |
| C.m+n<p+qQ>0 |
| D.m+n<p+qQ<0 |
在一条件下,可逆反应2A(气)+B(气)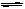 nC(固)+D(气)达平衡。若维持温度不变,增大强压,测得混合气体的平均相对分子质量不变,则下列判断正确的是()
nC(固)+D(气)达平衡。若维持温度不变,增大强压,测得混合气体的平均相对分子质量不变,则下列判断正确的是()
| A.其它条件不变,增大压强,平衡不发生移动 |
| B.其它条件不变,增大压强,混合气体的总质量不变 |
| C.该反应式中n值一定为2 |
D.原混合气中A与B的物质的量之比为2:1,且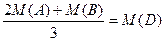 (其中M表示物质的摩尔质量) (其中M表示物质的摩尔质量) |
将8mol H2和2molN2充入2L密闭容器中,在一定条件下进行合成氨反应,4min后反应达到平衡,测得容器中还有5.6molH2。下列计算结果错误的是()
| A.v(H2)="0.3" mol·L-1·min-1 | B.H2的转化率为25% |
| C.NH3的物质的量浓度为0.8mol·L-1 | D.NH3的体积分数为19.05% |
A(气)+3B(气)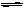 2C(气);△H="+Q" 达平衡后,将气体混和物的温度降低,下列叙述中正确的是()
2C(气);△H="+Q" 达平衡后,将气体混和物的温度降低,下列叙述中正确的是()
| A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动 |
| B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动 |
| C.正反应速率和逆反应速率变小,平衡向正反应方向移动 |
| D.正反应速率和逆反应速率变小,平衡向逆反应方向移动 |
反应4NH3(气)+5O2(气)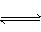 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
| A.v(NH3)=0.0100mol·L-1·s-1 |
| B.v(O3)=0.0010mol·L-1·s-1 |
| C.v(NO)=0.0010mol·L-1·s-1 |
| D.v(H2O)=0.045mol·L-1·s-1 |