以NA表示阿伏加德罗常数,下列说法正确的是 ( )
| A.如果5.6L N2含有n个氮分子,则阿伏加德罗常数一定约为4n |
| B.15.6g Na2O2与过量CO2反应时,转移的电子数为0.2NA |
| C.1L 1mol/L 的FeCl3溶液中含有铁离子的数目为NA |
| D.1mol的甲烷中含有的C—H共价键的数目为6NA |
用S-诱抗素制剂,可以保证鲜花盛开。S-诱抗素的结构如下图,下列关于该物质的说法正确的是
| A.S-诱抗素的分子式为C15H18O4 |
| B.既能发生加聚反应,又能发生缩聚反应 |
| C.1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH |
| D.既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
关于下列各图的叙述,正确的是

A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热(△H)为—241.8 kJ·mol-1
B.乙表示恒温恒容条件下,2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去)。当X是强碱时,过量B跟Cl2反应除生成C外,另一产物是盐酸盐。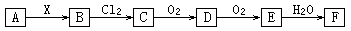
下列说法不正确的是
A.当X是强酸时,A、B、C、D、E、F均含同一种元素,F是H2SO4
B.当X是强碱时,A、B、C、D、E、F均含同一种元素,F是HNO3
C.当X是强碱时,C在常温下是固态单质
D.B也可在O2作用下直接转化为D
下列图示实验合理的是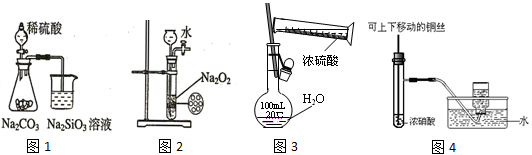
| A.图1为证明非金属性强弱:S>C>Si | B.图2为制备少量氧气 |
| C.图3为配制一定浓度硫酸溶液 | D.图4制备并收集少量NO2气体 |
下列离子方程式与所述事实相符且正确的是
| A.向稀氨水中逐滴加入稀硝酸银溶液配制银氨溶液:Ag++2NH3·H2O="[Ag" (NH3)2] ++2 H2O |
| B.用双氧水和稀硫酸可以蚀刻印刷电路板:Cu+H2O2+2H+=Cu2++2H2O |
C.硫化钾晶体溶于水:S2-+2H2 O 2OH-+H2S 2OH-+H2S |
| D.澄清石灰水与过量苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |