有X、Y、Z三种元素。其中X原子的价电子构型为2s22p2,Y原子的L电子层中有三个未成对电子,且无空轨道;Z的+1价离子是一个质子。试回答下列问题:
(1)写出Y原子价层电子排布图 ;
(2)ZXY分子中的三个原子除Z原子外均为8电子构型,写出该分子的结构式 ,根据电子云重叠方式的不同,分子里共价键的类型有 ;
(3)常温下,YZ3呈气态,但易被液化,且极易溶于水,其原因是 ;
(4)液态的YZ3是一种重要的溶剂,其性质与H2O相似,可以与活泼金属反应,写出Na与液态YZ3反应的化学方程式 。
某混合溶液中可能含有的离子如下表所示:
| 可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH 、Fe3+ 、Fe3+ |
| 可能大量含有的阴离子 |
Clˉ、Brˉ、Iˉ、CO32ˉ、AlO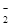 |
为探究其成分,进行了以下探究实验。
(1)探究一:
溶液的体积(V)的关系如下图所示。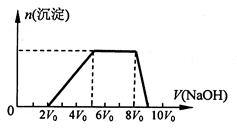
①该溶液中一定不存在的阳离子是______________ ,一定不存在的阴离子是__________;
②请写出沉淀减少过程中发生反应的离子方程式_____________________________。
(2)探究二:
乙同学检测到该溶液中含有大量的Clˉ、Brˉ、Iˉ,若向1 L该混合溶液中通入一定量的Cl2,溶液中Clˉ、Brˉ、Iˉ的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
11.2 L |
22.4 L |
28.0 L |
| n (Clˉ) |
2.5 mol |
3.5 mol |
4.0 mol |
| n (Brˉ) |
3.0 mol |
2.5mol |
2.0 mol |
| n (Iˉ) |
x mol |
0 |
0 |
①当起始至通入Cl2的体积为22.4L时,溶液中发生反应总的离子方程式为 ________________ ;
②原溶液中Clˉ、Brˉ、Iˉ的物质的量浓度之比为______________________。
某无色溶液,其中可能存在的离子有:Na+、Ag+、Fe3+、Ba2+、Al3+、AlO2-、S2-、SO32-、SO42-,现取该溶液进行实验,实验结果如下:
(1)生成沉淀甲的离子方程式为
(2)由溶液甲生成沉淀乙的离子方程式为;;试写出气体乙的结构式:;
(3)沉淀丙可能是;(填化学式)。
(4)综合上述信息,可以肯定存在的离子有 ;
(12分) X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为;若装置D中装的是五氧化二钒,
当通入足量YX2时,打开K通入适量X2,化学反应方程式为;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 E.双氧水 F.硝酸银 |
某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填如以下空格内。
(2)反应中,被还原的元素是,还原剂是。
(3)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为。
(本小题共4分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)离子方程式是重要的化学用语。下列是有关离子反应的一些错误观点,请在下列表格中用相应的一个“离子方程式”否定这些观点。(不能相同)
| ①强酸与强碱发生中和反应均可表示为:H++OH-=H2O |
|
| ②强酸与碱混合一定发生中和反应 |