(6分)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或 负 )。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑2NO2 N2O4)。
N2O4)。
(1)0.004molCu被硝酸完全溶解后,Cu失去的电子数是______________NA,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为____________。
(2)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式___________。
773 K、固定体积的容器中,反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。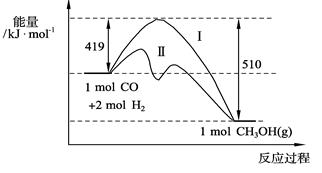
① 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为;
② 在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可)、;
③ 下列与催化剂有关的说法中,正确的是(填字母序号)。
a.使用催化剂,使反应CO(g)+2H2(g) CH3OH(g);ΔH>-91 kJ·mol-1
CH3OH(g);ΔH>-91 kJ·mol-1
b.使用催化剂, 能够提高反应物转化率
c.使用催化剂,不能改变反应的平衡常数K
下图是铜锌原电池装置。其电池的总反应是:Zn(s) + CuSO4(aq)="=" ZnSO4(aq) + Cu(s)。若该电池中两电极的总质量为300g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为298g。

请回答以下问题:
⑴R的名称是___________,其作用是__________________。R中的阳离子移向___________(填A或B)中的溶液。
⑵电极Y的材料是________,B中的电解质溶液是________________。
⑶X为原电池的___极,其电极反应式是______________。
(4)产生铜的质量为;转移的电子的物质的量为。
(5)高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如右图所示。
① Fe电极作极(填“阴”或“阳”);
② Ni电极的电极反应式为:。
化学反应速率可通过实验测定。要测定不同反应时刻反应物或生成物的浓度,可通过观察和测量体系中的某一物质的相关性质,再进行适当的转换和计算。如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的________来实现;在KMnO4与H2C2O4反应中,可通过观察单位时间内________________变化来测定该反应的速率;在Na2S2O3+H2SO4→Na2SO4+S↓+SO2↑+H2O反应中,该反应的速率可通过___来测定。
某化学反应的反应物和产物如下:
A1+NaNO3+H2O→A1(OH)3+N2+NaA1O2应的氧化剂是。
该反应的氧化产物是。
反应过程中转移5mole,生成标况下N2的体积L。
配平该反应的化学方程式:
A1+NaNO3+H2O→A1(OH)3+N2+NaA1O2