下面是某化学兴趣小组的同学对氢氧化钠部分性质的探究过程:

(1)用手触摸②的烧杯外壁,感觉发烫,这是由于氢氧化钠固体溶于水时会
(2)从③到④溶液的颜色变化不明显,说明④中的溶液呈
(3)
溶液和
溶液对比,
溶液颜色更浅.
【提出问题】
为什么继续通入过量的二氧化碳气体溶液颜色会更浅?
【设计实验】
| 实验操作 |
实验现象 |
实验结论 |
|
| 甲 |
取少量
溶液滴入稀盐酸 |
有气泡产生 |
溶液中含较多的 或 |
| 乙 |
另取少量
溶液滴入硝酸钙溶液 |
无明显现象 |
溶液中没有大量的 |
【实验结论】
根据甲、乙两个实验得出的结论,写出甲实验中发生反应的化学方程式:
【实验反思】
同种反应物在不同的条件下发生化学反应时,可能得到不同的产物.如:碳在氧气中燃烧可以生成
竹麻通过生石灰、草木灰(主要成分是 )浸泡以及打浆、抄纸等步骤可制得纸张。某兴趣小组模拟古代造纸技术,他们将一定量的生石灰、 足量的水溶解后,过滤得到澄清溶液。澄清溶液中溶质是什么,请你参与他们的探究。
【猜想假设】
猜想一:只含有
猜想二:含有 、_____
猜想三:含有 、
【设计实验】
|
实验步骤 |
实验现象 |
实验结论 |
|
1.取溶液少许于试管中,滴加过量稀盐酸 |
_____ |
猜想二不正确 |
|
2.取溶液少许于试管中,滴加少许_____溶液 |
_____ |
猜想三正确 |
【交流反思】
1.步骤2中发生反应的化学方程式为 _______________。
2.含有 、 的废水直接排放会造成水体污染。某小组同学对废水做如下处理(见如图)。C烧杯中出现__________现象时,说明废水中已无 、 。

海洋封存是实现“碳中和”的途径之一,其原理是利用 在水等溶剂中的溶解性来吸收 。某小组开展如下探究。
【活动一】探究 在水和食盐水(模拟海水)中的溶解情况
相同条件下,该小组分别用排水法、排食盐水法收集 (如图1),待收集 后,移出导管。每隔一段时间观察并记录量筒内 体积。重复实验,所测数据平均值如下表。

|
时间/ |
|
|
|
|
|
|
|
排水法时 体积/ |
|
|
|
|
|
|
|
排食盐水法时 体积/ |
|
|
|
|
|
|
(1)图1发生装置中反应的化学方程式为_____,反应类型是_____。
(2)由上表数据分析:
①能用排水法收集 的理由是_____。
②相同条件下,等体积水和食盐水吸收 更多的是_____(填“水”或“食盐水”)。
(3)海洋封存 可能带来的危害是_____(写出1点即可)。
【活动二】探究植物油隔离对 在水中溶解情况的影响
(4)小芳设计并完成以下对照实验:用两个量筒分别收集 倒置于水槽中,向其中一个量筒内注入少量植物油,使 与水被植物油隔开( 与植物油不反应)。测得量筒内 体积随时间变化曲线如图2。分析该图可得出的结论是_____。
【活动三】深度探究【活动二】中 的溶解情况
(5)①小松用图3表示无植物油隔离时,量筒内气体中存在的
分子的微观示意图。请参照图3的表示方式,在图4方框中画出有植物油隔离时,量筒内植物油和水中存在的分子的微观示意图(植物油分子用 表示)。
表示)。

②为检验有植物油隔离时 是否会进入水中,请设计实验方案:_________。
某小组用高锰酸钾制取氧气。如图是实验室中常见仪器,回答下列问题。

(1)仪器①的名称是_____。
(2)高锰酸钾制氧气的化学方程式为_____。组装氧气的收集装置,可选用_____(填序号)。
(3)某同学用排水法收集氧气时,发现水槽中的水变红了,可能是未使用_____(填实验用品名称)。若该同学收集的氧气不纯,原因可能是_____(写出1点即可)。
竹麻通过生石灰、草木灰(主要成分是 )浸泡以及打浆、抄纸等步骤可制得纸张。某兴趣小组模拟古代造纸技术,他们将一定量的生石灰、 用足量的水溶解后,过滤得到澄清溶液。澄清溶液中溶质是什么,请你参与他们的探究。
【猜想假设】
猜想一:只含有
猜想二:含有 、____
猜想三:含有 、
【设计实验】
|
实验步骤 |
实验现象 |
实验结论 |
|
1.取溶液少许于试管中,滴加过量稀盐酸 |
________ |
猜想二不正确 |
|
________ |
猜想三正确 |
【交流反思】
1.步骤2中发生反应的化学方程式为____________________。
2.含有 、 的废水直接排放会造成水体污染。某小组同学对废水做如下处理(见如图)。C烧杯中出现 ____________现象时,说明废水中已无 、 。

絮凝剂常用于水的净化,实验小组探究用絮凝剂净水时影响净化效果的因素。
【查阅资料】絮凝剂溶于水后能够吸附水中悬浮物并发生沉降,从而达到净水目的。硫酸铁是一种常见的絮凝剂。
【进行实验】
Ⅰ.配制水样和絮凝剂溶液
配制水样:向 水中加入 高岭土,搅拌、静置,取上层液作为水样。
配制絮凝剂溶液:用 水和 硫酸铁进行配制。
Ⅱ.探究影响水样净化效果的因素
取水样,向其中加入絮凝剂溶液,搅拌,测定静置不同时间水样的浊度,并计算浊度去除率(浊度去除率越高代表净化效果越好)。实验记录如下:
|
实验序号 |
水样的体积/ |
加入絮凝剂溶液的体积/ |
静置时间/ |
浊度去除率/ |
|
① |
|
|
|
|
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
|
|
⑤ |
|
|
|
|
|
⑥ |
|
|
|
|
|
⑦ |
|
|
|
|
|
⑧ |
|
|
|
|
|
⑨ |
|
|
|
|
【解释与结论】
(1)配制絮凝剂溶液的操作如图所示。
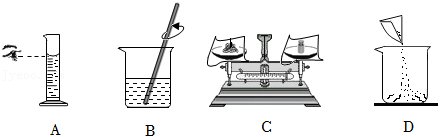
正确的操作顺序是_______(填序号), 中用玻璃棒搅拌的目的是_______。
(2)②中浊度去除率比①高的原因是_______。
(3)依据④~⑦得出的结论是______________。
(4)探究等量水样中加入絮凝剂溶液的体积对净化效果影响的实验是______________(填序号)。
【反思与评价】
(5)依据实验数据,不能得出“静置时间相同时,等量水样中加入絮凝剂溶液的体积越大,净化效果越好”的结论,其证据是_____________________。