下列有关实验的说法正确的是
| A.在中和热测定的实验中,将氢氧化钠溶液和盐酸混合反应后的最高温度作为末温度 |
| B.检验氯乙烷中的氯元素时,将氯乙烷和NaOH溶液混合加热后,先用稀硫酸进行酸化,再加入AgNO3溶液进行检验 |
| C.为了加快过滤速度以及得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法 |
| D.用纸层析法分离Cu2+和Fe3+,滤纸上端呈棕黄色,说明Fe3+在固定相中分配的更多 |
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 molH—H键断裂时吸收热量为
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
下列图示变化为吸热反应的是
下列有关化学键的说法中错误的是
| A.氯化钠熔化或氯化氢溶于水时都要破坏化学键 |
| B.离子化合物中可能含有共价键,共价化合物中一定不含有离子键 |
| C.氯化铵受热变成气体,冷却后又成晶体,此过程中化学键没有发生变化 |
| D.碘晶体升华和冰融化时都未涉及化学键的变化 |
如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是
| A.1 mol H2中的化学键断裂时需要吸收436 kJ能量 |
| B.2 mol HCl分子中的化学键形成时要释放862 kJ能量 |
| C.此反应的热化学方程式为:H2(g)+Cl2(g)===2HCl(g) ΔH=+183 kJ/mol |
D.此反应的热化学方程式为: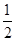 H2(g)+ H2(g)+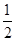 Cl2(g)===HCl(g) ΔH=-91.5 kJ/mol Cl2(g)===HCl(g) ΔH=-91.5 kJ/mol |
某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄绿色气体产生,则下列说法正确的是
| A.X2+具有强氧化性 | B.X的最高正价为+2价 |
| C.XO2具有强氧化性 | D.该元素是ⅡA族 |