某无色溶液中只可能溶有NH4+、K+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子。为分析其组成,现进行如下实验:
①取10mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲。
②取上述反应后的滤液,加入AgNO3溶液未见沉淀产生。
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解。
则下列说法正确的是
| A.仅由实验①可推出肯定含有SO42-,不含Cl- |
| B.该无色溶液肯定含有NH4+、K+、Al3+、SO42- |
| C.该无色溶液肯定不含K+、Mg2+、HCO3-、Cl-、MnO4-、I- |
| D.不能确定该无色溶液是否含有K+ |
青苹果汁遇碘水显蓝色,熟苹果汁与新制Cu(OH)2反应产生砖红色沉淀,说明()
| A.青苹果中只含淀粉不含糖类 | B.熟苹果中只含糖类不含淀粉 |
| C.苹果转熟时淀粉水解产生有葡萄糖 | D.苹果转熟时葡萄糖聚合成淀粉 |
下列反应中,属于取代反应的是( )
①CH3CH=CH2+Br2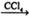 CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH 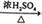 CH2=CH2↑+H2O
CH2=CH2↑+H2O
③CH3COOH+CH3CH2OH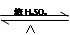 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3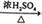 C6H5NO2+H2O
C6H5NO2+H2O
| A.①② | B.③④ | C.①③ | D.②④ |
香叶醇是合成玫瑰香油的主要原料,其结构简式如下:下列有关香叶醇的叙述正确的是()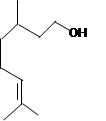
| A.香叶醇的分子式为C10H16O |
| B.不能用溴的四氯化碳溶液褪色 |
| C.不能使酸性高锰酸钾溶液褪色 |
| D.能发生加成反应,能发生取代反应 |
等质量的下列有机物完全燃烧,消耗O2最多的是( )
| A.CH4 | B.CH2= CH2 | C. |
D.CH3CH2OH |
C6H12和C2H6O的混合物中氧的质量分数为8﹪,则混合物中氢的质量分数为( )
| A.8﹪ | B.13﹪ | C.14﹪ | D.78﹪ |