元素性质呈周期性变化的决定因素是
| A.元素原子半径大小呈周期性变化 |
| B.元素原子最外层电子排布呈周期性变化 |
| C.元素的相对原子质量依次递增 |
| D.元素的最高正化合价呈周期性变化 |
下列有关化学与生活说法中,不正确的是
A. 是世界通用的循环再生标志,简称回收标志 是世界通用的循环再生标志,简称回收标志 |
| B.大量生产聚乙烯、聚氯乙烯一次性超薄袋,方便日常生活 |
| C.75%的乙醇溶液常用来消毒,是因为酒精能够使细菌蛋白质发生变性 |
| D.页岩气是从页岩层中开采出来的天然气。由于产气的页岩分布广、厚度大,且普遍含气,故可以成为新的化石燃料来源 |
海洋中有丰富的食品、矿产、能源和药物。下图是从海水中提取某些原料的流程图。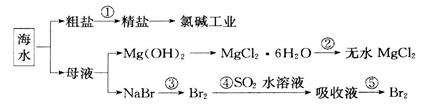
下列有关说法正确的是
| A.从海水中提取物质都必须通过化学反应才能实现 |
| B.第②步属于物理变化 |
| C.从第④~⑤步的目的是浓缩、富集溴单质 |
D.第①步中除去粗盐中的SO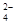 、Ca2+、Mg2+、Fe3+等杂质,加入试剂的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 、Ca2+、Mg2+、Fe3+等杂质,加入试剂的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
第Ⅱ卷(非选择题,共55分)
根据表中信息判断,下列选项不正确的是
| A.第①组反应中,H2O2作还原剂 |
| B.第②组反应中, Cl2与FeBr2的物质的量之比为3:2 |
| C.第③组反应中,每生成1molCl2转移电子2mol |
D.从三个反应可以得出:氧化性由强到弱顺序为MnO Fe3+>Cl2>Br2 Fe3+>Cl2>Br2 |
甲、乙、丙、丁四种物质之间存在如图所示转化关系,且甲、乙、丙均含有相同的某种元素。下列推断错误的是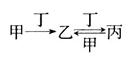
| A.若丙为CO2,则甲可以是焦炭 |
| B.若丁为O2,则甲可以是N2 |
| C.若丁为Fe,则甲可以是Cl2 |
| D.若丁为CO2,则甲可以是NaOH溶液 |
下列过程不涉及氧化还原反应的是
| A.二氧化氮气体冷却后颜色变浅 | B.镁条在二氧化碳气体中燃烧 |
| C.人工固氮 | D.久置的浓硝酸显黄色 |