下列变化或过程中发生化学变化的是
| A.氮的固定 | B.丁达尔效应 |
| C.实验室中制取蒸馏水 | D.用铂丝蘸取NaCl溶液进行焰色反应 |
下列反应中,在原理上可以设计成原电池的是
| A.Ba(OH)2·8H2O与NH4Cl的反应 | B.铝片与浓硫酸的反应 |
| C.甲烷与氧气的反应 | D.石灰石的分解反应 |
下列有关化学用语中,使用正确的是:
A.硫离子的离子结构示意图: |
B.CH4分子的比例模型: |
C.NH4Cl的电子式: |
D.聚丙烯的结构简式为: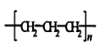 |
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
2005年6月,国内某知名媒体报道,国内啤酒生产企业中95%以上在生产过程中都填加了甲醛作为添加剂,在啤酒行业内引起极大反响。下列关于甲醛的说法中正确的是
A.甲醛分子组成中仅有C、H两种元素
B.甲醛是一种无色无味的气体,对人体无危害,所以,可以放心饮用啤酒
C.甲醛的化学性质很稳定,很难与强酸、强碱、强氧化剂反应
D.甲醛既可以被氧化生成甲酸、也可以还原生成甲醇
用一种试剂就能区分开苯酚、乙醇、NaOH溶液、AgNO3溶液、KSCN溶液这六种无色液体。它是
| A.溴水 | B.FeCl3溶液 | C.金属钠 | D.CuO |