某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验: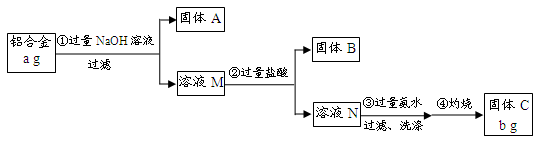
已知:(1)该铝合金的主要成分为铝、镁、铜、硅。
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
请回答下列问题:
(1)固体A的成分是 ;
(2)生成固体B的离子方程式为 ;
步骤③中生成沉淀的离子方程式为 ;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为
;
(4)该样品中铝的质量分数是 ;(用a、b表示)
(5)下列因操作不当,会使测定结果偏大的是 ;
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第③步中沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
(4分)氢气和氧气反应生成1mol水蒸气放热241.8KJ,已知氢气中H-H键能为436kJ/mol,氧气分子O=O键能为498 kJ/mol,则水分子中O-H键的键能为kJ/mol。若1 g水蒸气转化成液态水时放热2.5 kJ,则反应H2(g) + 1/2O2(g) ==H2O(l)的△H=kJ/mol
已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
1173 K情况下,K1、K2的值分别如下:
| 温度 |
K1 |
K2 |
| 973 K |
1.47 |
2.38 |
| 1173 K |
2.15 |
1.67 |
(1)通过表格中的数值可以推断:反应①是(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g) CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=。
(3)能判断反应③已达平衡状态的是。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式。据此关系式及上表数据,也能推断出反应③是(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________(填编号)。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
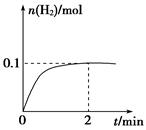
①0~2 min内的平均反应速率v(HI)=。该温度下,H2(g)+I2(g) 
2HI(g)的平衡常数K=。
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则是原来的2倍。
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡移动(填“向左”“向右”或“不”);若加入少量下列试剂中的,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1,某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的 能量转化率为________。
能量转化率为________。
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g) + 3H2(g) CH3OH(g) +H2O(g)△H="-49.0" kJ·mol-1。
CH3OH(g) +H2O(g)△H="-49.0" kJ·mol-1。
某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)
回答下列问题:
(1)该反应在0~8 min内CO2的平均反应速率是mol/(L?min)。
(2)该反应的平衡常数K=。
(3)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比曲线Ⅰ改变的条件可能是,曲线Ⅱ改变的条件可能是。若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是
(4)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的
| A.化学反应速率理论可指导怎样在一定时间内快出产品 |
| B.有效碰撞理论可指导怎样提高原料的转化率 |
| C.勒夏特列原理可指导怎样使用有限原料多出产品 |
| D.催化剂的使用是提高产率的有效方法 |
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
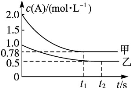
向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度为T),发生下列反应:A(g)+B(g)  xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示: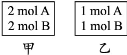
回答下列问题:
(1)乙容器中,平衡后物质B的转化率为。
(2)x=。
(3)下列说法正确的是( )
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
D.若甲容器为等压可变容器,向甲中充入惰性气体,则c(A)减小,平衡正向移动,v(正)、v(逆)减小