铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(杂质中不含铁元素,且杂质不与H2、H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定
实验结果:将5.0g铁矿石放入硬质玻璃管中完全反应, 测得装置B增重1.35 g。
Ⅱ.铁矿石中含铁量的测定
Ⅲ.问题讨论与解决:
(1)如要验证滤液A中铁元素的存在形式,可另取两份滤液A分别进行实验,实验方法、现象与结论如下表。请将其补充完整。
可供选择的试剂有:酸性KMnO4溶液、NaOH溶液、KSCN溶液、氯水
| 实验方法 |
实验现象 |
结论 |
| 步骤1:在滤液A中加入 |
|
滤液A中有Fe3+ |
| 步骤2:在滤液A中加入 |
|
滤液A中有Fe2+ |
(2)步骤④中煮沸的作用是: ;
(3)步骤③中反应的离子方程式为: ;
(4)请通过实验Ⅰ、Ⅱ计算出该铁矿石中铁的氧化物的化学式。(写出计算过程)
以下为五种有机物的有关信息,根据表中信息回答问题。
| A |
B |
D |
E |
F |
| ①由C、H、O 三种元素组成的液体; ②与水任意比例互溶。 |
其产量用来衡量一个国家的石油化工水平。 |
比例模型为: |
①可用于除水垢 ②在低于16.6℃时,凝固成冰一样的晶体。 |
由5个原子组成的10个电子的共价分子。 |
(1)A的官能团名称为________,对A的描述正确的是_________。
①有毒
②无色无味
③密度比水小
④与酸性高锰酸钾溶液反应使其褪色
⑤在海带提碘实验中作萃取剂从碘水中提取碘单质
⑥在热Cu丝作用下生成相对分子质量比它小2的有机物
A.①③⑤B.②③④C.③④⑥D.④⑤⑥
(2)B的电子式为 ,把一定体积的B、F混合气体通过溴水,有
反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为 g。(能用到的相对原子质量:H 1;C 12;O 16;Br 80)
(3)工业上,D来源于煤 (填操作名称)后的液态产物煤焦油。D在浓硫酸、
50~60℃水浴中与浓硝酸发生取代反应,生成的有机物的结构简式为 。
(4)写出用18O标记的A与不含18O的E在一定条件下发生反应的化学方程式(注明反应条件)。 。
下图为实验室进行该反应时的装置图,其中有 处错误。
(12分)Ⅰ.(1)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g) 2SO3(g),2min末测得容器中有7.2mol SO2。试回答:
2SO3(g),2min末测得容器中有7.2mol SO2。试回答:
①反应后18O原子存在于哪些物质中_____________________;
②2min末SO3的浓度_____________________;
③用O2的浓度变化表示该时间段内的化学反应速率_______________________。
Ⅱ.某化学反应2A(g) B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表: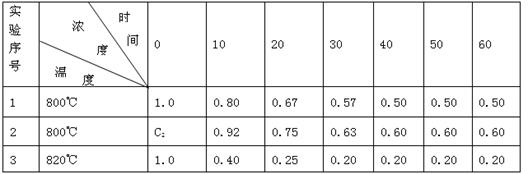
根据上述数据,完成下列填空:
(1)实验1达到平衡的时间是__________min,C2_____1.0 min·L-1(填“<”“>”或“=”)。
(2)实验3比实验1的反应速率_________(填“快”或“慢”),原因是______________。
(3)如果2A(g)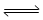 B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________。
B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________。
一定量的浓硫酸与足量Zn充分反应时有SO2和H2生成。某校化学研究性学习小组从定性方面对此作了研究。
按图组装好实验装置,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊,后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。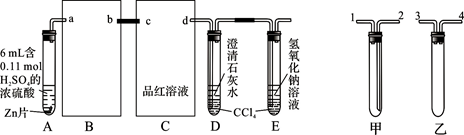
试回答下列问题:
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接______、______接b,c接______、______接d;D、E两支试管中CCl4的作用是________________________。
(2)能证明浓硫酸具有强氧化性的实验现象为_______________________________;实验过程中,浓硫酸表现强氧化性的反应方程式是:__________________________________
(3)反应较长时间后气泡量又会明显增加的原因是_______________________________。
利用下图所示实验(部分装置)收集氯气并验证氯气的性质: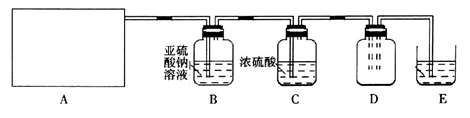
(1)A为Cl2的发生装置。若制取氯气的化学方程式为________________,与之对应的A装置是__________(填写装置的序号)。
(2)利用D中的广口瓶收集氯气,试在装置图中完善D装置(将虚线表示的一根或两根导管改为实线,也可都不改)。
(3)写出装置E中反应的离子方程式________________。
(4)利用D中收集的氯气进行铁与氯气的反应实验:用坩埚钳夹持一束细铁丝, ______________,然后伸入盛有氯气的集气瓶中。
(5)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-,反应的离子方程式为__________。试设计实验方案,检验洗气瓶B溶液中Cl 和SO
和SO 的存在。可供选择的试剂及仪器为:稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管。
的存在。可供选择的试剂及仪器为:稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管。
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
①向该待测液中加入过量的稀盐酸,有白色沉淀生成。
②过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
③过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
④另取少量步骤③中的滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)待测液中一定含有 离子,一定不含有 离子。
(2)还有一种离子无法确定是否存在,检验该离子实验方法的名称是 观察到的现象是 。