下列对实验现象的解释与结论,正确的是 ( )
| 选项 |
实验操作 |
实验现象 |
解释与结论 |
| A |
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 |
无砖红色沉淀生成 |
淀粉没有水解生成葡萄糖 |
| B |
向某无色溶液中滴加硝酸酸化的Ba(NO3)2溶液 |
有白色沉淀产生 |
该溶液中一定含有SO |
| C |
向某钠盐中加入稀盐酸,将产生的气体通入澄清石灰水 |
澄清石灰水变浑浊 |
说明该盐一定是碳酸盐 |
| D |
向蔗糖中加入浓硫酸 |
变黑,放热,体积膨胀,放出刺激性气体 |
浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等 |
下列示意图与对应的反应情况正确的是
A B C D
| A.含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2 |
| B.NaHSO4溶液中逐滴加入Ba(OH)2溶液 |
| C.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 |
| D.NaAlO2溶液中逐滴加入盐酸 |
某溶液中只可能含有下列离子中的几种:Na+、NH4+、Cl-、SO42-、CO32-(不考虑少量的H+与OH-),分别取100mL该溶液进行以下实验:①若加入足量的烧碱并加热,产生224mL(标准状况下)气体;②若先加入足量的HNO3无现象,再加入足量的Ba(NO3)2,得到2.33g固体。则该溶液
| A.肯定含有NH4+、SO42-、Cl-,且c(SO42-)=0.1mol/L |
| B.可能含有Na+和Cl- |
| C.一定含有Na+,且c(Na+)≥0.1mol/L |
| D.一定不含CO32-和Cl- |
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:
2FeSO4 + 6Na2O2= 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,对此反应下列说法中正确的是
| A.Na2O2只作氧化剂 |
| B.Na2FeO4既是氧化产物又是还原产物 |
| C.O2 是还原产物 |
| D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移 |
下列关于碳酸钠和碳酸氢钠的比较中,正确的是
| A.相同温度下,在水中,碳酸氢钠的溶解度大于碳酸钠的溶解度 |
| B.将石灰水加入碳酸氢钠溶液中不产生沉淀,加入碳酸钠溶液中产生白色沉淀 |
| C.将100 mL 0.10 mol/L盐酸溶液分别逐滴滴入到10 mL 1.00 mol/L的碳酸钠溶液或10 mL 1.00 mol/L碳酸氢钠溶液中,两者都能放出二氧化碳气体,但碳酸氢钠与酸反应产生二氧化碳的剧烈程度明显强于碳酸钠 |
| D.在一定温度下,物质的量浓度相同时,碳酸氢钠溶液的碱性弱于碳酸钠溶液 |
某氯原子的质量为a g , C-12原子的质量为b g,用NA表示阿伏加德罗常数,下列说法中不正确的是
A.则该氯原子构成氯分子的相对分子质量为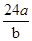 |
| B.1 mol该氯原子的质量为aNA g |
C.m g该氯原子的物质的量为 mol mol |
D.n g该氯原子所含的电子数为 |