在一密闭容器中,反应mA(g)  nB(g)+nC(g)达平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的2.2倍,则 ( )
nB(g)+nC(g)达平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的2.2倍,则 ( )
| A.物质C的质量分数增加了 | B.物质A的转化率减小了 |
| C.平衡向逆反应方向移动了 | D.m<2n |
设反应C(s)+CO2(g) 2CO(g)(正反应吸热),正反应速率为v1;N2(g)+3H2(g)
2CO(g)(正反应吸热),正反应速率为v1;N2(g)+3H2(g) 2NH3(g)(正反应放热),正反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为 ()
2NH3(g)(正反应放热),正反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为 ()
| A.v1增大、v2减小 | B.同时减小 | C.同时增大 | D.v1减小、v2增大 |
在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5mol/L,下列判断正确的是 ()
2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5mol/L,下列判断正确的是 ()
| A.x=1 |
| B.B的转化率为20% |
| C.平衡时A的浓度为1.50mol/L |
| D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85% |
一定条件下,体积为5L的密闭容器中,1molX和1molY进行反应: 2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是()
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是()
A.将容器体积变为10L,Z的平衡浓度变为原来的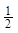 |
| B.以X浓度变化表示的反应速率为0.001mol/(L·S) |
| C.若升高温度,X的体积分数增大,则该反应的△H>0 |
| D.若增大压强,则物质Y的转化率增大 |
下列对化学平衡移动的分析中,不正确的是 ()
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动②已达平衡的反应N2(g)+3H2(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率减小③有气体参加的反应平衡时,若减小反应器容积时,平衡向气体体积增大的方向移动④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率减小③有气体参加的反应平衡时,若减小反应器容积时,平衡向气体体积增大的方向移动④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①③④ | C.①②③ | D.①②③④ |