设NA为阿伏加德罗常数的值,下列叙述不正确的
| A.5 g质量分数为46%的乙醇溶液中,氢原子的总数为0.6 NA |
| B.5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2 NA |
| C.50 mL 12 mol•L-1浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| D.常温常压下,46 g NO2 与N2O4的混合气体中含有的原子总数为3 NA |
下列实验操作与事故处理错误的是( )
| A.使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中 |
B.用试管夹从试管底由下往上夹住离试管口约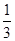 处,手持试管夹长柄末端,进行加热 处,手持试管夹长柄末端,进行加热 |
| C.制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中 |
| D.把玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进塞孔中 |
某物质A加热分解,产物都是气体,化学方程式为2A B+2C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
B+2C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
A.7d B.5d C.2.5d D.2d
一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是( )
A.次磷酸的电离方程式为H3PO2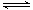 3H++PO23- 3H++PO23- |
| B.次磷酸中P的化合价为+1 |
| C.NaH2PO2是酸式盐 |
| D.NaH2PO2溶液显弱酸性 |
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3纳米)恢复了磁性,“钴酞菁”分子结构和性质与人体的血红素及植物体内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是( )
| A.在水中所形成的分散系属悬浊液 | B.分子直径比Na+小 |
| C.在水中形成的分散系能产生丁达尔效应 | D.“钴酞菁”分子不能透过滤纸 |
对相同状况下的 12C18O和 14N2 两种气体,下列说法正确的是( )
| A.若质量相等,则质子数相等 | B.若分子数相等,则体积相等 |
| C.若原子数相等,则中子数相等 | D.若体积相等,则密度相等 |