某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。请根据图像推断,下列说法中不正确的是(已知HCO3-与AlO2-在溶液中不能共存)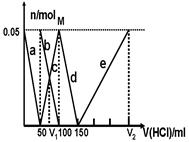
| A.M点时生成的CO2为0 mol |
| B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| C.V1:V2=1:4 |
| D.a段表示的离子方程式为:AlO2- +H+ + H2O=Al(OH)3↓ |
某有机化合物的结构如图,关于该化合物的下列说法正确的是
| A.由于含有氧元素不是有机物 |
| B.完全燃烧时只有二氧化碳和水两种产物 |
| C.分子中含有羟基属于醇 |
| D.不能使溴水褪色 |
下列事实,不能用勒夏特列原理解释的是
A.在溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后颜色变浅 HBr+HBrO,当加入NaOH溶液后颜色变浅 |
B.对2HI H2+I2(g)平衡体系增加压强使颜色变深 H2+I2(g)平衡体系增加压强使颜色变深 |
C.反应CO+NO2 CO2+NO ΔH<0升高温度使平衡向逆方向移动 CO2+NO ΔH<0升高温度使平衡向逆方向移动 |
D.合成氨反应:N2+3H2 2NH3 ΔH<0 为使氨的产率提高,理论上应采取低温高压的措施 2NH3 ΔH<0 为使氨的产率提高,理论上应采取低温高压的措施 |
下列各组中化合物的性质比较,不正确的是
| A.酸性:HClO4>HBrO4>HIO4 |
| B.碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C.稳定性:PH3>H2S> HCl |
| D.非金属性:F>O>S |
下列化学实验,能达到实验目的的是
| A.将MgCl2溶液小心蒸干得到无水MgCl2 |
| B.通过蒸馏分离苯和溴苯 |
| C.电解AlCl3溶液可以得到金属铝 |
| D.通过过滤从碘水中提取碘 |
下列离子方程式中正确的是
| A.稀硝酸和过量的铁屑反应:3Fe + 8H+ + 2NO3-=3Fe3+ + 2NO↑ + 4H2O |
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++ OH- NH3↑+ H2O NH3↑+ H2O |
| C.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2+ + OH- + H+ + SO42- = BaSO4↓ + H2O |
| D.KI溶液与H2SO4酸化的H2O2溶液混合:2I- + H2O2 + 2H+ =2H2O + I2 |