次磷酸钠(NaH2PO2)可用于化学镀镍。
(1)化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 mol。
(4)从二个反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:
碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应式:
①钠与过氧化钠反应
②钾还原硝酸钾,同时还产生了一种单质气体
某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用,不仅可以提高经济效益,而且还可防止环境污染。现按下列方式进行综合利用: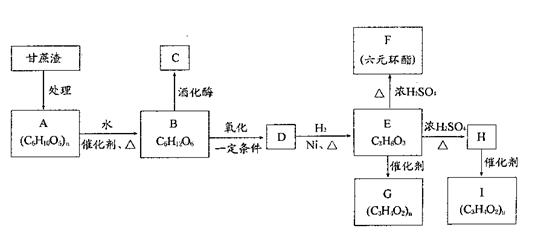
按要求完成问题:
(1)C的官能团名称:,D的结构简式:;
(2)写出化学方程式(有机物用结构简式表示):E→F:,H→I;
(3)写出下列转化的反应类型:E→G:,E→H:;
(4)已知X是B的同分异构体,且满足下列三个条件:
①X为六元环状化合物,含有母体: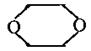
②X的母体: 上四个碳原子各连接1个支链或取代基。
上四个碳原子各连接1个支链或取代基。
③l mol X与足量的金属钠反应放出2molH2。
则符合上述条件的X的结构简式共有种(选填A、B、C、D)。
A.3 B.4 C.5 D.6
(12分。反应类型各1分,其余2分)
饱和亚硫酸溶液的pKa(电离平衡常数的负对数,即pKa=-lgKa)数据如下: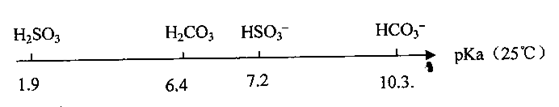
(1)比较H2SO3的Ka1和HSO3-的Ka2,Ka1Ka2(填‘‘>”、“<’’或“=”,下同)
(2)0.01 m ol.L-1NaHSO3溶液的pH=bl,0.01 tml·L-1NaHCO3溶液的pH=b2,
b1b2
(3)向10 mL 0.01 mol·L-1的H2SO3溶液中,滴加0.0l mol·L-1KOH溶液V(mL),
①当V="10" mL时,溶液中存在:c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+)c(OH-)
②当V="a" mL时,溶液中离子浓度有如下关系:c(K+)=2c(SO32-)+c(HSO3-);当V="b" mL时,溶液中离子浓度有如下关系:c(K+)=c(SO32-)+c(HSO3--)+c(H2SO3);则a b。
(4)已知25℃时,Ksp(BaSO4)=1×10-10,将0.1 gBaSO4沉淀,分别用100mL蒸馏水和100mL 0.01mo1.L-1H2SO4溶液洗涤,两种洗涤方法中BaSO4沉淀的损耗量之比为.
天然气的主要成分是甲烷。在某平衡体系中存在CH4、H2O、CO、H2四种气体,
其平衡常数表达式为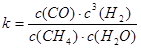 。已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷转化反应的影响如下图:
。已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷转化反应的影响如下图: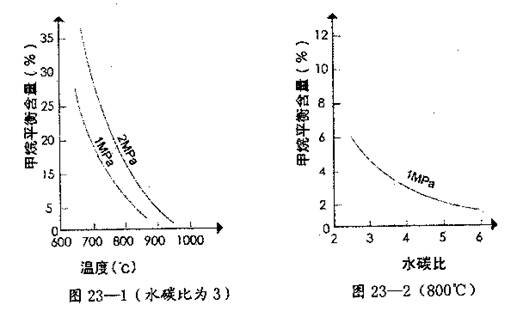
请回答下列问题:
(1)写出该可逆反应的化学方程式:
(2)根据图23—1判断△H0,△S0(选填“>”、“<”或“=”)。
(3)假设上述反应在恒容、恒温下进行,判断反应达到平衡状态时的标志是
| A.CO减少的化学反应速率和H2O(曲减少的化学反应速率相等 |
| B.CO、H2O(g)、CH4、H2的浓度都相等 |
| C.CO、H20(g)、CH4、H2的浓度都不再发生变化 |
| D.正、逆反应速率都为零 |
(4)在图23—2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。
各物质之间的转换关系如下图,部分生成物省略。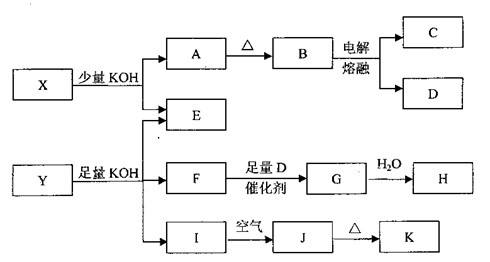
已知:①常温下,D、F、G为气体;C是日常生活中的常见金属;
②K的应用十分广泛,作为红色颜料跟某些油料混合,可以制成防锈油漆;
③E的水溶液中加盐酸无明显现象,然后加入BaCl2溶液出现浑浊。
请回答下列问题:
(1)写出F的电子式:;
(2)写出化学式:X、Y;
(3)写出C与KOH液反应的化学方程式:;写出H的稀溶液与I反应的离子方程式:;
有X、Y、z、w四种短周期元素,原子序数依次增大,其核电荷数总和为38。Y元素原子最外层电子数占核外总电子数的3/4;W元素原子最外层电子数比同周期Z元素原子最外层电子数多5个电子;W和 Y不属于同一主族。
(1)画出Y原子结构示意图:;
(2)从化合价角度分析,X元素可以排在周期表中I A、VIIA和族;
(3)Z、W两种元素最高价氧化物对应水化合物相互反应的化学方程式:;
(4)已知X2单质的热值为143 kJ·g-1,试写出X2单质在Y2单质中燃烧的热化学方程式:.