在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中: ①为氯气发生装置;②的试管里盛有15mL 30% KOH 溶液.并置于热水浴中; ③的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④的试管里加有紫色石蕊试液; ⑤为尾气吸收装置。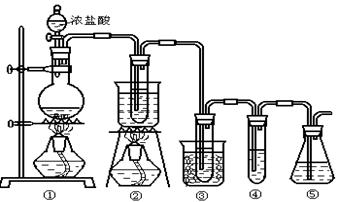
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过______(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(2)比较制取氯酸钾和次氯酸钠的条件.二者的差异是 。反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称)。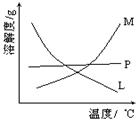
(3)本实验中制取次氯酸钠的离子方程式是: 。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 |
原因 |
| 溶液最初从紫色逐渐变为 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
______________________________________ |
| 然后溶液从无色逐渐变为 色 |
_________________________________________ |
某兴趣小组对物质的性质进行相关探究。
【提出问题】氯化氢(HCl)气体显酸性吗?
【进行实验】该兴趣小组的同学根据二氧化碳与水反应的实验探究方法,用三朵由紫甘蓝的汁液染成蓝紫色的纸质干燥小花进行如图1的三个实验:
实验现象:I和Ⅱ中小花不变色;Ⅲ中小花变红色。
【查阅资料】图2是同学们查阅的氯化氢气体溶于水的微观示意图。
【实验结论】氯化氢气体不显酸性。
【交流反思】
(1)从微观角度分析氯化氢气体不显酸性的原因是 。
(2)小明向实验Ⅲ中变红的小花上喷适当过量的稀氢氧化钠溶液,发现小花最后变成黄绿色,写出相关反应的化学方程式 。
(3)紫甘蓝的汁液在酸性溶液中显 色,在碱性溶液中显 色。
(4)下列实验可以用来说明氯化氢气体不显酸性的是 。
| A.测试盐酸的导电性,盐酸能导电 |
| B.干燥的碳酸钠粉末放人氯化氢气体中,不反应 |
| C.氢气与氯气反应,生成氯化氢气体 |
| D.干燥的碳酸钠粉末放人盐酸中,能反应 |
请结合下图回答问题:
(1)写出有标号的仪器名称:① ,② 。
(2)实验室用高锰酸钾制取O2的化学方程式为 ,用A、C装置制取O2时,为防止高锰酸钾进入导管,可采取的措施是 。
(3)实验室用B、D装置制取CO2的化学方程式为 ,若将发生装置由B改为F,其优点是 。
(4)SO2是无色有刺激性气味的有毒气体,密度比空气大,易溶于水。SO2的某些化学性质与CO2相似,实验中常用NaOH溶液吸收SO2尾气。用下图所示装置收集一瓶干燥的SO2,装置中导管按气流方向连接顺序是 →⑤(填序号);图中漏斗的作用是 ;烧杯中NaOH溶液的作用是 (用化学方程式表示)。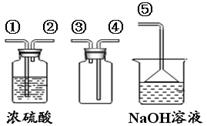
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定。学习小组的同学设计了滴定的方法测定x值。
①称取2.520 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.100 0 mol·L-1的KMnO4标准溶液进行滴定,达到终点时消耗20.00 mL。
(1)写出草酸(H2C2O4)与酸性高锰酸钾溶液反应的化学方程式____________。
(2)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
(3)本实验滴定达到终点的标志是__________。
(4)通过上述数据,求得x=________。
讨论:①若滴定终点时仰视滴定管刻度,则由此测得的x值会_______(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①准确称取mg干燥后的NaCl固体细粒并转移到定容仪器A中;
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,
计算出NaCl固体的体积V cm3。
(1)步骤①中仪器A最好使用_______________(填序号)
| A.量筒 | B.烧杯 | C.容量瓶 | D.试管 |
(2)步骤②中是否用酸式滴定管还是用碱式滴定管_____________,理由是__________。
(3)能否用水代替苯_________,理由是_____________________。
(4)已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm(如图),则用上述方法测得的阿伏加德常数NA的表达式为_______________。
如图是某研究性学习小组设计制取氯气并以氯气为原料进行特定反应的装置.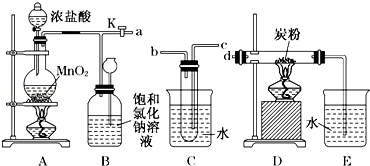
(1)写出A装置中发生反应的离子方程式_________;要将C装置接入B和D之间,正确的接法是:
a→ → →d;
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯,Cl2通过C装置后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为________.
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是 ,B的作用是 .
(4)用量筒量取20mL E中溶液,倒入已检查完气密性良好的分液漏斗中,然后再注入10mL CCl4,盖好玻璃塞,振荡,静置于铁架台上(如图),等分层后取上层液和下层液,呈黄绿色的是 (填“上层液”或“下层液”),能使有色布条褪色的是 (填“上层液”或“下层液”).
(5)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并在方框中画出改进后的装置图.