将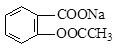 转变为
转变为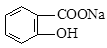 的方法为
的方法为
| A.与稀H2SO4共热后,加入足量Na2CO3 | B.与足量NaOH溶液共热后,再通入CO2 |
| C.与稀H2SO4共热后,加入足量NaOH | D.与足量NaOH溶液共热后,再加入稀硫酸 |
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| D.氨气分子是极性分子而甲烷是非极性分子 |
实验测得 BeCl2为共价化合物,两个Be—Cl键间的夹角为180°则BeCl2属于
| A.由极性键构成的极性分子 | B.由极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.由非极性键构成的非极性分子 |
下列各原子或离子的电子排列式错误的是
| A.Na+ 1s22s22p6 | B.F-1s22s22p6 |
| C.N3+ 1s22s22p6 | D.O2-1s22s22p6 |
下列各组物质中,每种物质都是既有离子键又有共价键的一组是
| A.NaOH 、H2SO4、(NH4)2SO4 | B.MgO、Na2SO4、 HNO3 |
| C.Na2O2、KOH、 Na3PO4 | D.HCl、 Na2O、 MgCl2 |
在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L、0.1mol/L。现向该混合液中加入1.92g铜粉,经加热充分反应后,所得溶液中的Cu2+的物质的量浓度(mol/L)是()
| A.0.15 | B.0.225 | C.0.35 | D.0.45 |