某元素原子的质量数为A,它的阳离子Xn+核外有x个电子,w克这种元素的原子核内中子数为
A.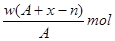 |
B.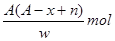 |
C.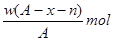 |
D.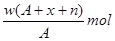 |
下列有关实验的叙述正确的是
| A.用HF溶液可以除去硅晶体中含有的少量二氧化硅晶体 |
| B.向两份Fe3O4固体中分别加入HCl溶液与HI溶液,二者反应原理一样 |
| C.向某溶液中滴加NaOH溶液后又加入酚酞,溶液呈红色,说明原溶液中含有NH4+ |
| D.向某溶液中加入足量的稀HNO3溶液,所得气体能使澄清石灰水变浑浊,证明该溶液中存在CO32-或HCO3- |
下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述不正确的是
| 元素代号 |
A |
B |
C |
D |
E |
F |
G |
| 原子半径/nm |
0.182 |
0.160 |
0.089 |
0.143 |
0.102 |
0.099 |
0.071 |
| 主要化合价 |
+1 |
+2 |
+2 |
+3 |
+6.-2 |
-1 |
-1 |
A.气态氢化物的稳定性HG>HF>H2E
B.B2+、D3+、E2-、G-四种离子的核外电子排布相同
C.A、E元素与氧元素可以形成三种常见的含氧酸盐
D.C元素的原子最外层电子数等于电子层数
反兴奋剂是体育赛事关注的热点,利尿酸是一种常见的兴奋剂,其分子结构如下:关于利尿酸的说法中,正确的是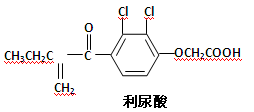
| A.它的分子式是C13H11O4Cl2 |
| B.它不能使酸性高锰酸钾溶液褪色 |
| C.它不能与饱和碳酸钠溶液反应放出CO2 |
| D.它能发生取代反应、加成反应和酯化反应 |
下列说法不正确的是
| A.Na2O2能与CO2反应,可用作呼吸面具的供氧剂 |
| B.硅是半导体材料,可用于制备光导纤维 |
| C.明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| D.Al2O3熔点高,可用于制作耐高温仪器 |
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是
| A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X |
| B.X、Z两元素能形成原子个数比(X︰Z)为3︰1和4︰2的化合物 |
| C.化合物YW2、ZW2都是酸性氧化物 |
| D.用M单质作阳极,石墨作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀 |