“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。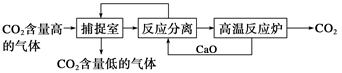
下列有关该方法的叙述中正确的是
| A.能耗小是该方法的一大优点 |
| B.整个过程中,只有一种物质可以循环利用 |
| C.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤 |
| D.该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品 |
【原创】下列离子方程式错误的是
| A.锅炉中可以用纯碱除水垢: CaSO4 + CO32-═ CaCO3+ SO42- |
| B.用KMnO4测定蔬菜中草酸含量:2MnO4-+5H2C2O4+6H+ =2Mn2+ +10CO2↑+8H2O |
| C.Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2↑+S↓+2H2O |
D.用铜电极电解饱和氯化钠溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
【原创】用NA表示阿伏加德罗常数,下列说法错误的是
| A.2g重水(2H2O)中含有的质子数为NA |
| B.1 mol NaHSO4在熔融时离子总数为3NA |
| C.常温常压下,等质量的CO2、N2O含有相同的分子数 |
| D.1molNa2O2与足量CO2充分反应转移的电子数目为NA |
【原创】化学与生产、生活、社会密切相关。下列有关说法中,错误的是
| A.新农村建设大量使用秸秆制取沼气,符合低碳理念 |
| B.卤水点豆腐、血液透析、静电除尘都是利用了胶体的性质 |
| C.洪水过后的水源很浑浊,可加入明矾净化和消毒 |
| D.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
【改编】常温下,下列有关叙述错误的是
| A.在NaHCO3溶液中:c(OH-)+ c(CO32-) = c(H2CO3) + c(H+) |
| B.在pH=8的NaB溶液中 :c(Na+)-c(B-)=9.9×10-7 mol•L-1 |
| C.浓度均为0.1 mol·L-1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+ c(H2CO3) |
| D.向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≤20mL |
下列图示与对应的叙述相符的是
| A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 |
| B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
| C.图丙表示催化剂能改变化学反应的焓变 |
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |