镁—过氧化氢燃料电池具有比能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4==MgSO4+2H2O,结构示意图如图所示。下列关于该电池的叙述正确的是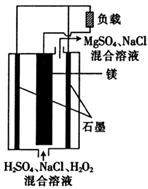
| A.想要实现该反应,电池内部可以使用MnO2作填料 |
| B.电流工作时,H+向Mg电极移动 |
| C.电池工作时,正极的电极反应式为Mg—2e-==Mg2+ |
| D.电池工作时,电解质溶液的pH将不断变大 |
下列有关“化学与生活”的叙述不正确的是()
| A.烧结粘土制陶瓷涉及化学变化 |
| B.加工后具有吸水性的植物纤维可用作食品干燥剂 |
| C.点燃爆竹后,硫燃烧生成SO3 |
| D.服用阿司匹林出现水杨酸反应时,用碳酸氢钠溶液解毒 |
已知以下反应可用于去除大气中的污染:NO2+NH3 +O2—一N2+H2O(未配平)。若NO2、NH3、
O2三者恰好反应,则体积比可能是
| A.2:4:1 | B.2:1:2 | C.l:1:1 | D.l:4:3 |
已知反应:CO(g) +3H2 (g)  .CH4 (g)+H2O(g)。起始以物质的量之比为1:1充人反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为)。下列有关说法正确的是
.CH4 (g)+H2O(g)。起始以物质的量之比为1:1充人反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为)。下列有关说法正确的是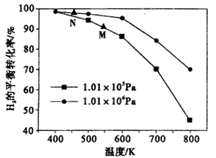
| A.上述反应的△H<0 |
| B.N点时的反应速率一定比M点快 |
| C.降低温度,H2的转化率可达到100% |
| D.工业用此法制取甲烷应采用更高的压强 |
下列有关物质的性质类比正确的是
A.已知Fe+S FeS,则Cu+S FeS,则Cu+S CuS CuS |
| B.Fe能与CuSO4溶液反应,可知Al与CuSO4溶液也能反应 |
| C.CaS03与稀盐酸反应生成SO2,可知CaSO3与稀硝酸反应也生成SO2 |
| D.已知H2O2能氧化I一,可知H2O2也能氧化Cl- |
某款香水中的香氛主要由以下三种化合物构成,下列说法正确的是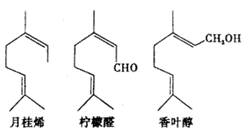
| A.月桂烯分子中所有原子可能共平面 |
| B.柠檬醛和香叶醇是同分异构体 |
| C.香叶醇能发生加成反应、氧化反应、酯化反应 |
| D.三种有机物的一氯代物均有7种(不考虑立体异构) |