用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.8 g甲烷含有的共价键数约为NA |
| B.常温常压下,22.4 L二氧化碳原子总数为3NA |
| C.1 mol Fe与稀HNO3反应,一定转移3 NA个电子 |
| D.1mol单质硅含有2molSi-Si键 |
X(g)+aY(g) bZ(g)
bZ(g)
反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
| A.a=1,b="1" | B.a=2,b="1" |
| C.a=2,b="2" | D.a=3,b=2 |
| A.氯化氢的摩尔质量等于NA个氯分子和NA个氢分子的质量之和 |
B.常温常压下1 mol NO2气体与水反应生成NA个NO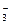 离子 离子 |
| C.121 g CCl2F2所含的氯原子个数为2NA |
D.62 g Na2O溶于水后所得溶液中含有O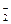 离子数为NA 离子数为NA |
| A.CH4·14H2O | B.CH4·8H2O |
C.CH4·7 H2O H2O |
D.CH4·6H2O |
| A.将金粉和铜粉混合 |
| B.将牛奶加入水中混合 |
| C.蒸发食盐水制取食盐晶体 |
| D.用漏斗、滤纸过滤除去水中的泥沙 |
| A.同主族金属的原子半径越大,熔点越高 |
| B.稀有气体原子序数越大沸点越高 |
| C.分子间作用力越弱分子晶体的熔点越低 |
| D.同周期元素的原子半径越小越易失去电子 |