已知25℃ Ksp(Ag2S)=6.3×10-50、Ksp(AgI)=1.5×10-16,Ag2S难溶于水和稀盐酸,可溶于硝酸,其反应方程式为Ag2S + 4HNO3=2AgNO3+2NO2↑+S↓+2H2O,下列说法正确的是
| A.该反应中氧化剂与氧化产物的物质的量之比为4:1 |
| B.生成3.2g S同时放出4.48LNO2 |
| C.AgI的悬浊液中滴加K2S溶液可转化成黑色沉淀 |
| D.若将产物NO2收集于密闭容器里再置于冷水中,气体颜色变深 |
常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度为( )
A.0.01mol·L-1 B.0.05mol·L-1C.0.017 mol·L-1 D.0.50mol·L-1
室温时某无色溶液pH=6.0,则向该溶液中分别滴入甲基橙、石蕊试液、酚酞试液,溶液的颜色分别变为( )
| A.红色、紫色、红色 | B.黄色、红色、无色 |
| C.黄色、紫色、无色 | D.黄色、紫色、红色 |
用0.1 mol•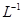 的盐酸滴定0.10 mol•
的盐酸滴定0.10 mol•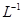 的氨水,滴定过程中不可能出现的结果是( )
的氨水,滴定过程中不可能出现的结果是( )
A. > >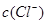 , , > > |
B. = =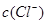 , , = = |
C.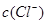 > > , , > > |
D.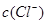 > > , , > > |
化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是( )
| A.平衡常数的大小与温度、浓度、压强、催化剂等有关 |
B.Ksp(AgCl) > Ksp(AgI) ,由此可以判断AgCl(s) + I-(aq)  AgI(s)+ Cl-(aq)能够发生 AgI(s)+ Cl-(aq)能够发生 |
| C.当温度升高时,弱酸的电离平衡常数Ka变小 |
| D.化学平衡常数不变时,说明化学反应已达化学平衡状态 |
化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
| A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
B.电解熔融 ,可制得金属镁 ,可制得金属镁 |
| C.在铁制品上镀银时,镀件为阳极,银盐为电镀液 |
| D.明矾水解形成的Al(OH) 3胶体能吸附水中悬浮物,可用于水的净化 |