某研究性学习小组同学向Fe(NO3)3溶液中滴加淀粉KI溶液后,溶液呈蓝色。他们对Fe(NO3)3溶液中将I-氧化的氧化剂进行了如下探究:
【实验】分别向FeCl3溶液和HNO3溶液中滴加淀粉KI溶液后,发现溶液均显蓝色。
(1)FeCl3溶液与KI溶液反应的离子方程式为 。
(2)KI与HNO3反应的离子方程式为I-+H++NO3-→NO↑+I2+H2O(未配平),反应中氧化剂与还原剂的物质的量之比为 。
【提出假设】假设1:氧化剂只有Fe3+ 假设2:氧化剂只有NO3-(H+)
【设计实验方案,验证假设】
(3)请设计实验验证上述假设
供选试剂:0.2mol•L-1的Fe(NO3)3溶液、0.2mol•L-1的KI溶液、0.01mol•L-1的KMnO4酸性溶液、0.01mol•L-1的KSCN溶液、CCl4溶液、淀粉溶液。(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)
| 实验步骤 |
预期现象和结论 |
| ①取5ml0.2mol•L-1的Fe(NO3)3溶液和5ml0.2mol•L-1的KI溶液,充分反应后加入5ml CCl4溶液,振荡静置,取上层溶液,分置于A、B两支试管中 |
|
| ② ③ |
若溶液不变红色,则假设1成立,否则假设1不成立; 若溶液显紫色,则假设2成立,否则假设2不成立 |
【思考与交流】(4)若Fe(NO3)3与KI反应的过程中,Fe3+和NO3-(H+)均参与氧化I-,则上述实验中步骤②和③的预期现象分别是什么? 。
在75℃左右,用HgSO4做催化剂,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种:现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如下图所示,请回答下列问题;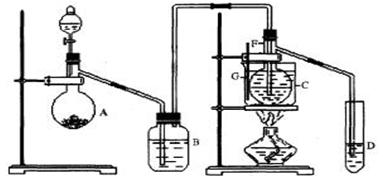
(1)实验开始时,仪器A中盛放电石,B中应装____________,其作用是_____ ______ _____
___________________________________。
(2)仪器D中盛放水,其作用是_________________________________________________。
(3)蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括 HgO在内的各试剂的名称____________________。将HgO加放F中的操作方法是________________
HgO在内的各试剂的名称____________________。将HgO加放F中的操作方法是________________
___________________。
(4)装置图中,加热F的方法叫___________,所选用温度计G的量程表示正确的是______。(填代号)。
| A.0℃~50℃ | B.0℃~100℃ | C.0℃~200℃ |
| D.50℃~100℃E. 0℃~360℃ |
(5)检验乙醛已制出的操作及现象______________________________________________。
聚合硫酸铁又称聚铁,化学式为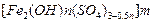 ,广泛用于污水处理。
,广泛用于污水处理。
某化学兴趣小组在实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、Si02等)
制备聚铁和绿矾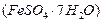 的过程如下:
的过程如下: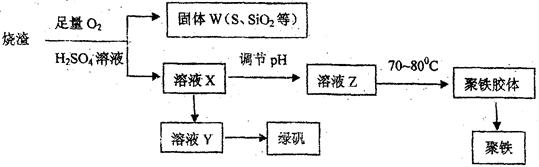
(1) 验证固体W焙烧后产生的气体含有SO2的方法是。
(2) 实验室制各、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各
仪器接口,顺序为a→→→→→f,装置D的作用是,装置E中NaOH溶液的作用是。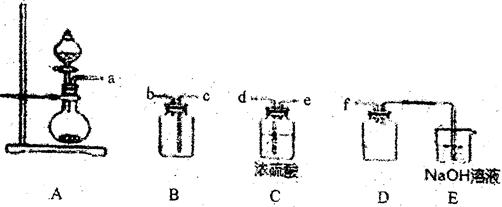
(3) 制备绿矾时,内溶液X中加入过量,充分反应后,经
操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用PH试纸测定溶渡pH的操作方法为
。
实验室用下图装置制取少量溴苯,试填写下列空白。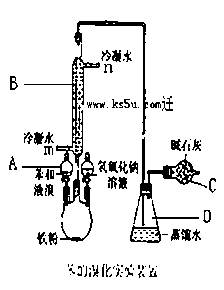
(1).写出仪器A的名称;B的名称;
(2).请你写出实验室制取溴苯的化学方程式 ___ ;
(3).长导管的下口为什么不插入锥形瓶的液面下
(4).反应完毕后向烧瓶A中滴加NaOH 溶液的作用是
(5).冷凝水的进水口是(填m或n),,图中干燥管C的作用是
下图所示是进行木炭与浓硝酸反应,并检验生成的气体和反应的热效应的实验装置,它具有无污染,现象明显的特点。具支试管A中所盛固体下层是无水CaCl2(作载体不参加反应),上层是红热的木炭。实验时慢慢将浓硝酸滴到木炭上,反应即开始进行
且能长时间剧烈反应。请回答下列问题:
|
|
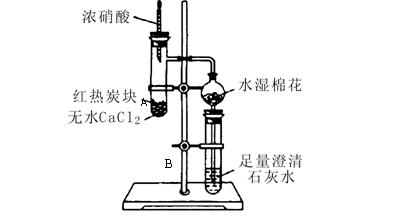
 ;澄清石灰水中发生的主要反应的离子方程式为: 。
;澄清石灰水中发生的主要反应的离子方程式为: 。
 几滴浓硝酸使
几滴浓硝酸使 木炭反应完全,最简单的办法是 。
木炭反应完全,最简单的办法是 。
(17分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题: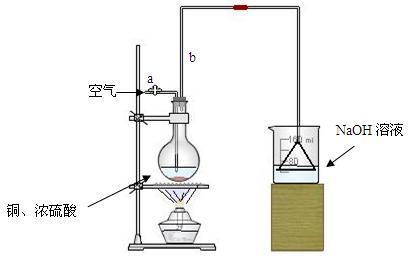
⑴首先根据上图所示,组装实验装置,并在加入试剂前先进行操作。
⑵烧杯中用NaOH溶液吸收的物质是:(填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是:。
⑶加热烧瓶20分钟,烧瓶中发生反应的化学方程式是:。待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的
(填仪器名称)起到了确保硫酸体积保持不变的作用。
⑷将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行、、后称量硫酸钡的质量为13.98g,请计算能与铜反应的硫酸的浓度最低是。
⑸有的同学提出在上面⑷中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:
。