关于图中各装置的叙述不正确的是
| A.装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
| B.装置②能测量锌与硫酸的反应速率 |
| C.装置③能验证铁的吸氧腐蚀 |
| D.装置④的X电极是负极,则能验证外接电源的阴极保护法 |
下列关于电解质溶液的叙述正确的是( )。
| A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大 |
| B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C.中和pH与体积均相同的盐酸和醋酸,消耗NaOH溶液的物质的量相同 |
| D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
在下列各组的比较中,前者比后者大的是( )。
| A.25 ℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 |
| B.25 ℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度 |
| C.同温度、同浓度的NaCl溶液和氨水的导电能力 |
| D.25 ℃时,pH均为3的盐酸和FeCl3溶液中水的电离程度 |
在Na2CO3溶液中,下列离子浓度的关系正确的是( )。
| A.c(Na+)=2c(CO32-) | B.c(H+)>c(OH-) |
| C.c(CO32-)<c(HCO3-) | D.c(OH-)>c(H+) |
T ℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图(1)所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图(2)所示。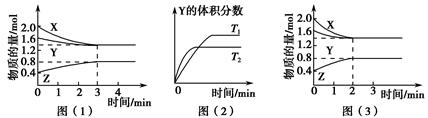
则下列结论正确的是( )。
| A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1 |
B.容器中发生的反应可表示为3X(g)+Y(g) 2Z(g) 2Z(g) |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图(3)所示,则改变的条件是增大压强 |
为了变废为宝,控制温室效应,工业上可用CO2来生产甲醇。一定条件下发生如下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是( )。
CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是( )。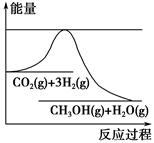
| A.降低温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出来 |
| D.再充入1 mol CO2和3 mol H2 |