氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是
A.NH4H的电子式为 |
B.NH4Cl的电子式为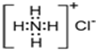 |
| C.NH4H含有极性共价键和离子键 | D.NH4H固体投入少量热水中,有两种气体生成 |
反应SO2(g)+NO2(g)  NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是( )
NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是( )
| A.平衡左移,容器内压强一定增大 |
| B.平衡右移,达到平衡时容器压强一定增大 |
| C.平衡不一定发生移动,容器内压强一定增大 |
| D.平衡右移,SO2的转化率提高 |
在一定条件下,某容器中充入N2和H2合成NH3,以下叙述错误的是( )
| A.开始反应时,正反应速率最大,逆反应速率为零 |
| B.随着反应的进行,正反应速率逐渐减小,最后减小为零 |
| C.随着反应的进行,逆反应速率逐渐增大,最后保持恒定 |
| D.随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等且都保持恒定 |
下图是表示2X(g)+Y(s)  Z(g)+R(g)(正反应放热)的气体反应速率(v)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是( )
Z(g)+R(g)(正反应放热)的气体反应速率(v)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是( )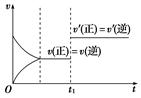
| A.减少Z的物质的量 | B.减小压强 |
| C.升高温度 | D.使用催化剂 |
反应:A(g)+3B(g)  2C(g) ΔH<0;达平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
2C(g) ΔH<0;达平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
| A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动 |
| B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动 |
| C.正反应速率和逆反应速率都变小,平衡向正反应方向移动 |
| D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动 |
下列事实不能用化学平衡移动原理解释的是( )
| A.在强碱存在的条件下,酯在水中溶解度增大 |
| B.加催化剂,使N2和H2在一定条件下转化为NH3 |
| C.可用浓氨水和氢氧化钠快速制取氨气 |
| D.加压条件下有利于SO2与O2反应生成SO3 |