(共6分)一定温度下,在一定容积的密闭容器中发生如下可逆反应:
2A(g)+B(g) 2C(g) ,在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度)。试回答下列问题:
2C(g) ,在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度)。试回答下列问题: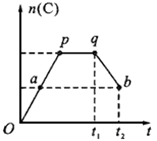
(1)a点时,反应的v(正) v(逆)(填“>”、“<”或“=”);
(2)此反应的逆反应为 热反应(填“放”或“吸”);
(3)a、b两点的正反应速率:v(a) v(b)
(填“>”、“<”或“=”)。
(1)对于下列反应:2SO2 + O2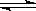 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
(2)右图表示在密闭容器中反应:2SO2+O2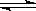 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,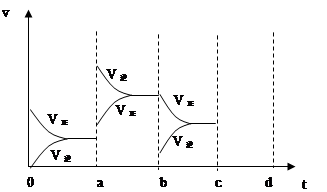
a b过程中改变的条件可能是;b c过程中改变的条件可能是; 若增大压强时,反应速度变化情况画在c~d处.
(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅绿色消失,溶液变成稀盐酸:.
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ。
(3)液态肼与液态双氧水反应中当有1mol氧化产物生成时转移电子的物质的量是
(4)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点
是
铝是生活中非常常见的一种金属,运用所学知识回答:
(1)金属铝是活泼的金属,可在生活中应用很广泛,原因是。
(2)在一个瘪了的铝制易拉罐加入适量的NaOH溶液,并密封,易拉罐会慢慢复原,原因是(用化学方程式表示)。
(3)铝粉与氧化铁粉末在高温下得到铁的反应叫做“铝热反应”,发生反应的化学方程式为。
我国规定饮用水质量标准必须符合下列要求:
| pH |
6.5~6.8 |
| Ca2+、Mg2+总浓度 |
<0.0045mol/L |
| 细菌总数 |
<100个/L |
以下是源水处理成自来水的工艺流程示意图:
源水→曝气池 一级沉降池
一级沉降池 二级沉降池
二级沉降池 过滤池→自来水
过滤池→自来水
(1)源水中含Ca2+ 、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式。
(2)凝聚剂除去悬浮固体颗粒的过程(填写编号,多选倒扣分)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成沉淀。
(3)通入二氧化碳的目的是和。
(4)气体A的作用是。这种作用是基于气体A和水反应的产物
具有性.
(5)下列物质中,可以作为气体A的代用品。(填写编号,多选倒扣分)
①Ca(ClO)2 ②NH3 (液) ③K2FeO4 ④SO2
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图3—2所示的游码尺上画出游码的位置(画“|”表示)。
| 砝码质量/g |
50 |
20 |
20 |
10 |
5 |
| 取用砝码情况 |

(2)图3—3表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中的液体的体积是__________mL。
(3)用18mol•L—1的硫酸溶液配制0.5mol•L—1的硫酸溶液250mL所需的玻璃仪器为___________。