乙烯是石油裂解气的主要成分,其产量通常用来衡量一个国家石油化工发展水平。回答下列问题:
(1)乙烯的结构简式为 。
(2)下列能鉴别甲烷和乙烯的试剂是 。(填序号)
| A.稀硫酸 | B.溴的四氯化碳溶液 |
| C.水 | D.酸性高锰酸钾溶液 |
(3)若以乙烯为主要原料合成乙酸,其合成线路如下图所示
① B物质官能团的名称 。
② 反应Ⅱ的化学方程式为 ,反应类型是 。
③ 工业上以乙烯为原料可以合成一种重要的有机高分子化合物,该反应的化学
方程式为 。
有A、B、C、D、E、F六种主族元素,已知:
(a) A原子有四个电子层,其K、L层电子数分别与N、M层电子数相等
(b) B、C原子核外电子层比A原子少一层,B的最高正价和负价的代数和等于零.C的气态氢化物化学式是H2C.
(c) D、E的阴离子都带一个单位的负电荷,D的阴离子电子层结构与氩原子相同.E元素没有对应的含氧酸.
(d) F与A属同一周期且是上述六种元素中原子半径最大元素。
(1)它们的元素中文名称为:A:_______ B:________ C:_______ D:_________ E:________F:__ __
(2)A、C、D、F四种元素的离子半径由大到小的顺序为 。
(3)B、C、D元素的气态氢化物的稳定性有强到弱的顺序为 。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)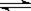 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.υ正(H2)=υ逆(H2O)D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(10分)对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,除去铁锈的化学反应的离子方程式为:________________________。
(2)利用右图装置,可以模拟铁的电化学防护。
①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为____ ____。
(3)上图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时, 转移的电子数为 NA。铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:___________________。
(8分)请认真观察右图,然后回答问题:
(1)图中所示反应是_______(填“吸热”或“放热”)反应,该反应的ΔH=________(用含E1、E2的代数式表示)。
(2)下列4个反应中,符合示意图描述的反应的是________。
a.盐酸与NaOH反应b.Na与H2O反应生成H2
c.铝热反应 d.灼热的碳与CO2反应
(3)途径(II)与途径(Ⅰ)相比改变的措施可能是 .
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如(下面左图):

(1)Cu元素基态原子的外围电子排布式为 。
(2)元素C、N、O的第一电离能由大到小排列顺序为 。
(3)A中碳原子的轨道杂化类型分别为 。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为 。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体: (写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如(上面右图),则该化合物的化学式是 。