主链上有6个碳原子,有一个甲基和一个乙基作为支链的烷烃有
| A.3种 | B.4种 | C.5种 | D.6种 |
下列能用勒夏特列原理解释的是
| A.Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B.棕红色NO2加压后颜色先变深后变浅 |
| C.SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D.H2、I2、HI平衡混合气加压后颜色变深 |
已知25℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨,s)+O2(g)===CO2(g) ΔH=-393.51 kJ/mol
C(金刚石,s)+O2(g)===CO2(g) ΔH=-395.41 kJ/mol
据此判断,下列说法中正确的是
| A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的能量低 |
| B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的能量高 |
| C.由石墨制备金刚石是放热反应;金刚石比石墨更稳定 |
| D.由石墨制备金刚石是吸热应;石墨比金刚石更稳定 |
可逆反应aA(g) + bB(g) cC(g) + dD(g)符合下图。则下列叙述正确的是
cC(g) + dD(g)符合下图。则下列叙述正确的是
| A.a+b < c+d;正反应吸热 | B.a+b > c+d;正反应放热 |
| C.a+b < c+d;正反应放热 | D.a+b > c+d;正反应吸热 |
在相同温度、不同压强( )下,可逆反应2X(g)
)下,可逆反应2X(g)  2Y(g) +Z(g)中,生成物Z在反应混合物中的体积分数(
2Y(g) +Z(g)中,生成物Z在反应混合物中的体积分数( )与反应时间(
)与反应时间( )的关系有以下图示,正确的是
)的关系有以下图示,正确的是
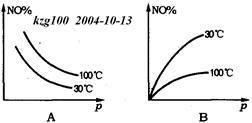
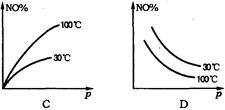
在2NO+O2 NO2△H>0反应中,表明在30℃和100℃时平衡体系中NO的百分含量与反应体系总压强p的关系是下图中的
NO2△H>0反应中,表明在30℃和100℃时平衡体系中NO的百分含量与反应体系总压强p的关系是下图中的
|