(原创)用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,46g NO2中含有的分子数为NA |
| B.通常状况下,14g CO含有的电子数目为7NA |
| C.1L 0.2 mol/L的CH3COOH溶液中,H+ 数目为0.2NA |
| D.0.1mol Cu 和与40mL 10mol/L硝酸反应后,溶液中的NO3-数目为0.2NA |
(14分)X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为零;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)________________________
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是
(写分子式)_____________________
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系: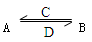
(在水溶液中进行),其中C是溶于水显酸性的气体,D是淡黄色固体。
写出C的结构式_____________;D的电子式____________________。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为_______________,由A转化为B的离子方程式____________________________________________________________
②如果A由三种元素组成 ,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因______________________________________________。
某有机物(如图)是农药生产中的一种中间体,其结构简式如下。下列叙述正确的是
| A.该有机物属于芳香烃 |
| B.该有机物可以和Br2的CCl4溶液发生加成反应 |
| C.该有机物和浓硫酸混合加热,可能发生消去反应 |
| D.1mol该有机物和足量的NaOH溶液反应,最多可与3mol NaOH反应 |
有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl¯、SO42-、HCO3¯、MnO4-¯中的一种或几种.为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体产生无色无味的气体并生成白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生.下列推断正确的是
| A.肯定有K+、HCO3¯、MnO4-¯ |
| B.肯定有Al3+、Mg2+、HCO3¯ |
| C.肯定有Al3+、Mg2+、SO42- |
| D.肯定有Al3+、Mg2+、NH4+、Cl¯ |
能正确表示下列反应的离子方程式为
| A.硫化亚铁溶于稀硝酸中:FeS+2H+ ═Fe2++H2S↑ |
| B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH- ═ CO32-+H2O |
C.MnO2与浓盐酸反应制Cl2: MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O Mn2++2Cl-+Cl2↑+2H2O |
| D.大理石溶于醋酸中:CaCO3 + 2CH3COOH ═ Ca2+ + 2CH3COO- + CO2↑+ H2O |
NA表示阿伏加德罗常数,下列叙述中正确的是
| A.通常状态下,NH4+和NH2-¯各1 mol含有的电子数均为10NA |
| B.标准状况下当氧气与氦气的原子数均为NA时,它们具有相同的体积 |
| C.在100 mL 1 mol/L乙酸溶液中含乙酸的分子数为0.1NA |
| D.1 mol硫化氢在氧气中完全燃烧时,转移的电子数为2NA |