一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=" -lg" c(M),pc(CO32-)= -lgc(CO32-)。下列说法正确的是 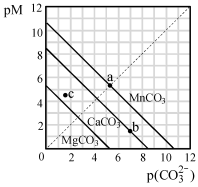
| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.a 点可表示MnCO3的饱和溶液,且c(Mn2+)= c(CO32-) |
| C.b 点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c 点可表示MgCO3的不饱和溶液,且c(Mg2+)﹥c(CO32-) |
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。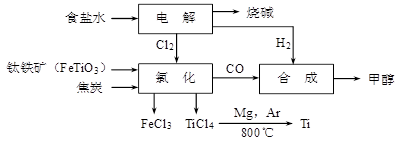
请回答下列问题:
(1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图_______。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式。
(3)氯碱厂获得Cl2的离子方程式为
| TiCl4 |
Mg |
MgCl2 |
Ti |
|
| 熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
| 沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
(4)由TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于℃即可。
(5)为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为 时,理论上Cl2的利用率最大。
标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.2 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3 g。则下列关于该过程的推断不正确的是
| A.混合气体中氯气物质的量为0.04 mol |
| B.混合气体中SO2物质的量为0.04 mol |
| C.所得的沉淀为0.1 mol BaSO4 |
| D.a的取值范围为1.344< a <1.792 |
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如下图所示,该电池放电时,右槽中的电极反应为:V2+ - e-= V3+,下列说法正确的是
| A.放电时,右槽发生还原反应 |
| B.充电时,阴极电解液pH升高 |
| C.充电时,每转移lmol电子,n(H+)的变化量为l mol |
| D.放电时,左槽的电极反应式:VO2++ 2H+ + e-= VO2++ H2O |
N2 (g)+3H2 (g)  2NH3(g) ΔH=-92.4 kJ·mol-1。 1L密闭恒容容器中,反应体系中各物质浓度随时间变化的曲线如图示。
2NH3(g) ΔH=-92.4 kJ·mol-1。 1L密闭恒容容器中,反应体系中各物质浓度随时间变化的曲线如图示。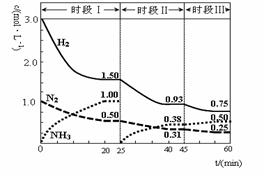
下列说法错误的是:
| A.前20分钟反应物的转化率为50% |
| B.第25分钟改变的条件是将NH3从反应体系中分离出去 |
| C.时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数增大 |
| D.若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |
用图所示装置进行下列实验,实验结果与预测的现象不一致的是
| ①中的物质 |
②中的物质 |
预测①的现象 |
|
| A |
酚酞溶液 |
浓氨水 |
溶液变红色 |
| B |
酚酞溶液 |
浓硝酸 |
无明显变化 |
| C |
饱和CuSO4溶液 |
浓硫酸 |
无明显变化 |
| D |
FeCl3溶液 |
KSCN溶液 |
无明显变化 |