有机物B,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。其余为氧。A的产量可以衡量一个国家石油化工发展水平。 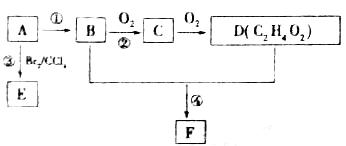
(1)B的分子式是 。A的结构简式 。
(2)B能与金属钠反应放出氢气,则B结构中含有的官能团的电子式为 。
(3)反应②在Cu作催化剂的条件下进行,其现象是 。该反应的化学方程式为 。
(4)反应①的反应类型是 。反应③的化学方程式为 。
(5)B与高锰酸钾酸性溶液反应可生成D。在加热和浓硫酸作用下,B与D反应可生成一种有香味的物质F,若184 g B和120 g D反应能生成132g F,该反应的化学方程式为 ,其中B的转化率为 。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_______________________
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应_______________________________
负极反应_______________________________
某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 |
电极材料 |
电解质溶液 |
电流计指针偏转方向 |
| ① |
Mg 、Al |
稀盐酸 |
偏向Al |
| ② |
Al、Cu |
稀盐酸 |
偏向Cu |
| ③ |
Al、石墨 |
稀盐酸 |
偏向石墨 |
| ④ |
Mg、Al |
NaOH溶液 |
偏向Mg |
| ⑤ |
Al、Zn |
浓硝酸 |
偏向Al |
根据上表中的实验现象完成下列问题:
(1)实验①、②中Al所作的电极是否相同?
答:____________________________________________
(2)写出实验③中的电极名称、电极反应式和电池总反应方程式。铝为( )______________________________
石墨为( )__________________________
电池总反应:__________________________
(3)实验④中的铝作________极。
(4)实验⑤中铝作________极。
(1)1.00 L 1.00 mol·L-1 H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ热量,表示生成1 mol H2O的热化学方程式为_________________________
(2)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,C6H6的标准燃烧热为____________kJ·mol-1,该反应的热化学方程式为_______________________________________________
工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为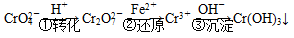
其中第①步存在平衡:
2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O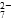 (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的 pH = 2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是________。
a.Cr2O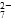 和CrO
和CrO 的浓度相同
的浓度相同
b.2v(Cr2O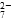 )=v(CrO
)=v(CrO )
)
c.溶液的颜色不变
(3)第②步中,还原 1 mol Cr2O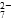 离子,需要______mol的FeSO4·7H2O。
离子,需要______mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法
该法用 Fe 做电极电解含Cr2O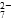 的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
(5)用Fe做电极的原因为______________________________________
(6)在阴极附近溶液 pH 升高的原因是(用电极反应解释)________________,溶液中同时生成的沉淀还有________。
臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是________和________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。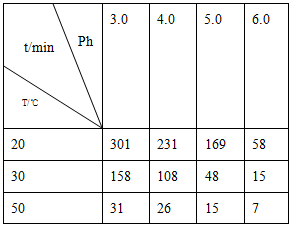
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40℃、pH=3.0 b.10℃、pH=4.0
c.30℃、pH=7.0
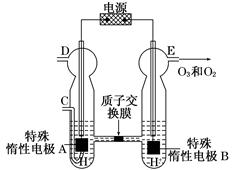
(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
①图中阴极为________(填“A”或“B”),其电极反应式为_______________________。
②若C处通入O2,则A极的电极反应式为________。
③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为________(忽略O3的分解)。