短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
| A.X的氢化物溶于水显酸性 | B.Y的氧化物是共价化合物 |
| C.其离子半径大小: Z>Y>X | D.X和Z的最高价氧化物对应的水化物都是强酸 |
下列图示与对应的叙述相符的是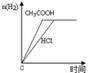
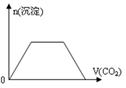
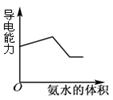

图1图2图3图4
| A.图1表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉 |
| B.图2表示向Ba(OH)2、KAlO2混合溶液中通入CO2 |
| C.图3表示表示向盐酸和醋酸混合溶液中滴入氨水 |
| D.图4表示在含等物质的量NaHCO3、Na2CO3的混合溶液中滴加0.1mol·L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
下列叙述中正确的是
| A.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| C.液溴易挥发,在存放液溴的试剂瓶中应加水封 |
| D.硝酸亚铁溶液中要加入稀硝酸抑制水解,防止溶液变浑浊 |
为除去下列各混合物中的杂质(括号内为杂质),所加试剂和采用的方法均正确的是
| 选项 |
需除杂的物质 |
所加试剂 |
主要操作 |
| A |
Na2CO3(NaHCO3) |
不加任何试剂 |
加热 |
| B |
Al2O3(SiO2) |
NaOH溶液 |
过滤 |
| C |
NO(NO2) |
NaOH溶液 |
洗气 |
| D |
CO2(SO2) |
Na2CO3溶液 |
洗气 |
瘦肉精(Clenbuterol)是一种非常廉价的药品,但它有很危险的副作用,轻则导致心律不整,严重一点就会导致心脏病。瘦肉精是白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚。其结构如图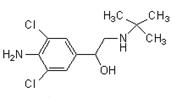 所示,对于瘦肉精的说法正确的是
所示,对于瘦肉精的说法正确的是
| A.瘦肉精的化学式:C12H17N2Cl2O |
| B.瘦肉精既含有氨基又含有羟基,因此是一种两性化合物 |
| C.能用乙醚等有机溶剂将瘦肉精从水溶液中萃取出来 |
| D.一定条件下瘦肉精能发生取代、加成、水解等反应 |
水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O32-+2H2O,下列说法正确的是
| A.x=2 | B.Fe2+、S2O32-都是还原剂 |
| C.硫元素被氧化,铁元素被还原 | D.每生成1 mol Fe3O4,则转移电子的物质的量为3 mol |