以下说法正确的是( )
| A.不能自发进行的反应属于吸热反应 |
| B.化学键断裂时吸收的能量大于化学键形成时放出的能量的反应属于放热反应 |
| C.升高反应的温度,活化分子百分数增加,分子间有效碰撞的几率提高,反应速率增大 |
| D.催化剂通过改变反应路径,使反应速率增大,但不改变反应所需的活化能 |
某无色溶液可能存在Al3+、H+、Na+、SO32-、CO32-、NO3-、AlO2-和S2-八种离子中的几种,进行如下实验:①向溶液中加入足量的稀盐酸,产生无色气体;②继续滴加BaCl2溶液,产生白色沉淀;③过滤后,向滤液中逐滴加入NaOH溶液,产生白色沉淀;继续滴加,白色沉淀消失。由此推断原溶液中()
| A.一定存在的离子是Na+、SO32-、CO32-、AlO2- |
| B.可能存在的离子是Al3+、CO32- |
| C.一定存在的离子是Na+、SO32-、NO3- 、AlO2- |
| D.可能存在的离子是CO32-、S2- |
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色透明溶液。若加入乙醇将析出深蓝色晶体。下列说法不正确的是()
| A.生成的难溶物是Cu(OH)2 |
| B.在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤对电子 |
| C.沉淀溶解后将生成深蓝色的正四面体形的配离子[Cu(NH3)4]2+ |
| D.加入极性较小的溶剂乙醇后,将析出[Cu(H2O)4]SO4·H2O晶体 |
把一块镁铝合金投入到1mol/LHCl溶液里,待合金完全溶解后,往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图A所示。下列说法不正确的是()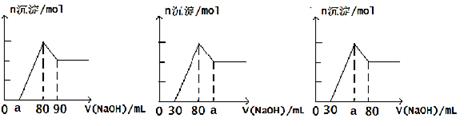
图A图B图C
| A.A图中a的取值范围为0≤a<50 |
| B.A图中n(Mg)/n(Al)的最大值为2.5 |
| C.若将关系图改为B图时,则a的取值范围为80<a<90 |
| D.若将关系图改为C图时,则a的取值范围为67.5<a<80 |
某集气瓶内装的混合气体是红棕色,加入足量水,盖上玻璃片震荡,溶液变成橙黄色,气体颜色消失。再打开玻璃片,瓶中气体又变为红棕色。该混合气体可能是()
| A.N2、NO2、Br2 | B.NO2、NO、N2 |
| C.NO2、O2、NO | D.N2、NO、Br2 |
下列说法正确的是()
| A.某微粒空间构型为平面三角形,则中心原子一定是sp2杂化 |
| B.某微粒空间构型为V形,则中心原子一定有孤电子对 |
| C.某微粒空间构型为三角锥形,则该微粒一定是极性分子 |
| D.某微粒空间构型为正四面体,则键角一定是109°28’ |