某课外活动小组用下图进行实验,试回答下列问题。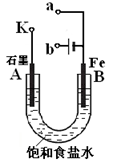
(1)若开始时开关K与a连接,则B极的电极反应式为 ;
(2)若开始时开关K与b连接,则B极的电极反应式为 ;
总反应的离子方程式为 ;
(3)当开关K与b连接时,下列说法正确的是(填序号) 。
①溶液中Na+向B极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加入适量的盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移了0.2mol电子
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
| A.升高温度 | B.增大压强 | C.充入一定量氮气 | D.再加入一些铁粉 |
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将 (填“增大”、“减小”、“不变”),该反应的平衡常数K= ,温度升高,K (填“增大”、“减小”、“不变”)。
(4)铁的重要化合物在生产生活中应用十分广泛。高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g)+O2(g)==2CO2(g) △H=-566 kJ/mol;2H2(g)+O2(g)==2H2O(g) △H=-483.6 kJ/mol。写出CO和H2O(g)作用生成CO2和H2的热化学方程式 。
(6)已知Ksp(Fe(OH)3)= 8´10-38,某溶液中含有Fe3的浓度是0.05mol×L-1。如果要使Fe(OH)3沉淀完全pH至少为 (溶液中离子浓度小于1×10-5mol/L时,沉淀完全,lg2=0.3)
短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
(1)已知相关物质之间存在如下变化:
①丁与乙和水反应生成戊和丙的离子方程式为,由物质己电解得到单质D的化学方程式为;
②0.1mol/L的丙溶液中所含离子浓度由大到小排列顺序为;常温下,为使丙溶液中由丙电离的阴、阳离子浓度相等,应向溶液中加入一定量的乙的水溶液至。
(2)已知E及其化合物有以下变化:
写出单质E与化合物Z在一定条件下反应生成X和水的化学方程式____,由A、B、C、D、E5种元素中的两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为(任写一个即可)。
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的C的含氧酸盐的化学式是。
A. 海底热液研究(图1)处于当今科研的前沿。海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物。
(1) Ni2+的核外电子排布式是____________________。
(2) 分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,基主要原因是 。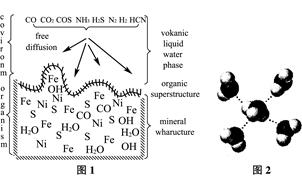
| 电离能/kJ·mol-1 |
I1 |
I2 |
| 铜 |
746 |
1958 |
| 锌 |
906 |
1733 |
(3) 下列说法正确的是________。
A. 电负性:N>O>S>C B. CO2与COS(硫化羰)互为等电子体
C. NH3分子中氮原子采用sp3杂化 D. CO、H2S、HCN都是极性分子
(4) “酸性热液”中大量存在一价阳离子,结构如图2,它的化学式为________________。
(5) FeS与NaCl均为离子晶体,晶胞相似,前者熔点为985℃,后者801℃,其原因是____________________________________________。在FeS晶胞中,与Fe2+距离相等且最近的S2-围成的多面体的空间构型为________________。
B. 制备KNO3晶体的实质是利用结晶和重结晶法对KNO3和NaCl的混合物进行分离。下面是某化学兴趣小组的活动记录:
| NaNO3 |
KNO3 |
NaCl |
KCl |
|
| 10℃ |
80.5 |
20.9 |
35.7 |
31.0 |
| 100℃ |
175 |
246 |
39.1 |
56.6 |
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
实验方 案:
案:
Ⅰ. 溶解:称取29.8g KCl和34.0g NaNO3放入250mL烧杯中,再加入70.0g蒸馏水,加热并搅拌,使固体全部溶解。
Ⅱ. 蒸发结晶:继续加热和搅拌,将溶液蒸发浓缩。在100℃时蒸发掉50.0g水,维持该温度,在保温漏斗(如图所示)中趁热过滤析出的晶体。得晶体m1g。
Ⅲ. 冷却结晶:待溶液冷却至室温(实验时室温为10℃)后,进行减压过滤。得KNO3粗产品m2g。
Ⅳ. 重结晶:将粗产品全部溶于水,制成 100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。
100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。
假定:① 盐类共存时不影响各自的溶解度;② 各种过滤操作过程中,溶剂的损耗忽略不计。试回答有关问题:
(1) 操作Ⅱ中趁热过滤的目的是 。
(2) 若操作Ⅱ中承接滤液的烧杯中不加入蒸馏水,则理论上在操作Ⅲ中可得粗产品的质量m2=______g,其中混有NaCl______g。为防止NaCl混入,在操作Ⅱ中承接滤液的烧杯中至少应加入蒸馏水______g。
(3) 操作Ⅲ中采用减压过滤,其优点是______________________________________。该小组同学所用的装置如右图所示,试写出该装置中主要用到的玻璃仪器的名称:________________。若实验过程中发现倒吸现象,应采取的措施是______________________________________。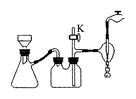
拉氧头孢钠是一种抗生素,合成拉氧头孢钠的中间体G的路线如下: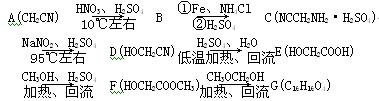
(1) B的结构简式为____________________。
(2) E―→F的反应类型为________________。
(3) 酚的苯环上某些氢原子比较活泼。由E合成F时还可能生成一种相对分子持量为194的副产物H,H的结构简式为______________________。
(4) M是E的同分异构体,M具有以下特征:① 苯环上只有2个取代基;② 遇氯化铁显色,但与小苏打不反应;③ 1mol M最多能与2mol NaOH溶液反应。则M的结构有________种。
(5) G含有酯基,请写出F―→G的化学反应方程式: 。
(6) 写出由化合物E制备化合物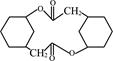 的合成路线流程图(无机试剂任选)。合成路线流程图示例:
的合成路线流程图(无机试剂任选)。合成路线流程图示例: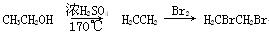
环己烷()在负载纳米Au的分子筛(Au/TS1)催化剂的作用下与空气发生氧化反应,反应原理是:通过游离基反 应形成环己基过氧化氢,该过氧化物在Au/TS1催化作用下受热分解,生成环己醇和环己酮(O)。由于环己醇、环己酮比环己烷更容易被氧化,因而有许多副产物(如己二酸及一些酯类化合物)生成。
应形成环己基过氧化氢,该过氧化物在Au/TS1催化作用下受热分解,生成环己醇和环己酮(O)。由于环己醇、环己酮比环己烷更容易被氧化,因而有许多副产物(如己二酸及一些酯类化合物)生成。
(1) 下表是某反应温度下,环己烷催化氧化反应的转化率(x)和目标产物的选择性(S)的结果:
| 催化剂 |
转化率(x)/% |
|||
| 目标产物的选择性(S)/% |
||||
| 环己基过氧化氢 |
环己醇 |
环己酮 |
||
| Au/TS1 |
10.4 |
14.1 |
34.9 |
39.8 |
① 写出环己烷催化氧化为环己酮的化学方程式: 。
② 若在反应容器中加入1.0mol环己烷,则生成的环己酮的物质的量为________(保留2位小数)。
(2) 图甲是反应温度对环己烷催化氧化反应的转化率(x)和目标产物的选择性(S)和目标产物的总收率(y)的影响。
① 由图甲可知:该反应较适宜的反应温度为________左右。
② 随着反应温度的升高,环己烷的转化率(x)逐渐增加,而目标产物的选择性(S)和 目标产物的总收率(y)却逐渐降低,其可能的原因是 。
目标产物的总收率(y)却逐渐降低,其可能的原因是 。
(3) 图乙是反应时间对环己烷催化氧化反应的转化率(x)和目标产物的选择性(S)和目标产物的总收率(y)的影响。
① 由图乙可知,该反应较适宜的反应时间为________左右。
② 随着反应时间的延长,环己烷的转化率(x)逐渐增加,而目标产物的选择性(S)逐渐降低,这说明________________________________________________________。