下列说法正确的是( )
A.草酸氢钾溶液呈酸性,在0.1mol·L-1KHC2O4溶液中:c(C2O )>c(H2C2O4) )>c(H2C2O4) |
B.在小苏打水溶液中:c(Na+)+c(H+)=c(HCO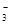 )+c(CO )+c(CO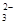 )+c(OH-) )+c(OH-) |
| C.相同温度下,1 mol/L氨水溶液与0.5mol/L氨水溶液中,c(OH-)之比是2:1 |
D.当氨水与盐酸恰好完全反应时,c(NH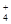 )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
分类方法在化学学科的发展中起到了非常重要的作用,下列分类标准合理的是
①根据碳酸钠水溶液呈碱性,则碳酸钠既属于盐,又属于碱
②根据化合物水溶液能否导电将化合物分为电解质和非电解质
③根据分散系中的分散质粒子大小将分散系分为溶液、胶体和浊液
④根据反应过程中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
| A.①③ | B.②④ | C.①④ | D.③④ |
下列离子检验的方法正确的是
| A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl﹣ |
| B.某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有SO42﹣ |
| C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+ |
| D.某溶液中加稀硫酸溶液生成无色气体,说明原溶液中有CO32﹣ |
下列说法正确的是
| A.向NaOH溶液中慢慢滴加FeCl3饱和溶液,可制得Fe(OH)3胶体 |
| B.胶体与其他分散系的本质区别是胶体能发生丁达尔效应 |
| C.除去Fe(OH)3胶体中的Na+和Cl﹣可用过滤的方法 |
| D.Fe(OH)3胶体中逐滴加入稀硫酸,会产生沉淀而后沉淀溶解 |
下列离子方程式正确的是
| A.铁和稀盐酸反应:2Fe + 6H+ = 2Fe3++3H2↑ |
| B.碳酸钠与盐酸反应:CO32-+2H+ = CO2↑+H2O |
| C.氢氧化钡与稀盐酸的反应:Ba(OH)2+2H+ = Ba2++2H2O |
| D.铜片插入硝酸银溶液中:Cu+Ag+ = Cu2++Ag |
下列说法正确的是
| A.1 mol氢约含有6.02×1023个微粒 |
| B.H2的摩尔质量是2 g |
| C.1 mol O2的质量是32 g,含有的氧原子数为2NA |
| D.2NA个H2SO4分子的摩尔质量为196 g/mol |