下列反应的离子方程式正确的是( )
| A.NaHCO3溶液中加入盐酸:CO32-+ 2H+ = CO2↑+ H2O |
B.紫色石蕊试液中滴入氢硫酸变红的原因是:H2S 2H+ + S2- 2H+ + S2- |
| C.将NaHSO4溶液滴入Ba(OH)2溶液中至pH=7:2H+ + SO42-+ 2OH-+ Ba2+ = BaSO4↓+ 2H2O |
D.电解CuSO4溶液:Cu2+ + 2H2O Cu + O2↑+ 4H+ Cu + O2↑+ 4H+ |
下列说法正确的是
| A.元素周期表每一周期元素原子的最外层电子排布均是从ns1 过渡到ns2np6 |
| B.元素周期表中ⅢB到ⅡB的10个纵行的元素都是金属,统称过渡金属元素 |
| C.原子核外电子排布为1s1的原子与原子核外电子排布为1s22s1的原子的化学性质相似 |
| D.所有的非金属元素都分布在p区 |
短周期金属元素甲~戊在元素周期表中的相对位置如下表所示,下面判断正确的是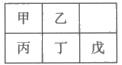
| A.原子半径:丙<丁<戊 |
| B.金属性:甲>丙 |
| C.氢氧化物碱性:丙>丁>戊 |
| D.最外层电子数:甲>乙 |
在乙烯分子中有5个σ键、1个π键,它们分别是
| A.碳原子sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 |
| B.碳原子sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 |
| C.C—H之间是sp2杂化轨道形成的σ键,C—C之间是未参加杂化的2p轨道形成的π键 |
| D.C—C之间是sp2杂化轨道形成的σ键,C—H之间是未参加杂化的2p轨道形成的π键 |
现有四种元素的基态原子的电子排布式如下:①ls22s22p63s23p4②ls22s22p63s23p3③ls22s22p3④ls22s22p5 , 则下列有关比较中正确的是
| A.第一电离能:④>③>②>① | B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① | D.最高正化合价:④>③=②>① |
已知[ZnCl4]2-中Zn2+的4s轨道和4p轨道形成sp3型杂化轨道,则[ZnCl4]2-的空间构型为
| A.直线形 | B.平面三角形 |
| C.平面正方形 | D.正四面体形 |