在容积为VL的密闭容器中放入2LA和1LB,3A(g)+B(g)  nC(g)+2D(g),达到平衡后,A物质的量减少1/2,混合气体的平均摩尔质量增大1/8,则该反应中n的值( )
nC(g)+2D(g),达到平衡后,A物质的量减少1/2,混合气体的平均摩尔质量增大1/8,则该反应中n的值( )
| A. 1 | B. 2 | C. 3 | D. 4 |
某有机物结构式为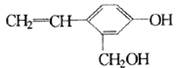 ,它不可能具有的性质是:
,它不可能具有的性质是:
①可以燃烧 ②能使酸性高锰酸钾溶液褪色 ③能跟KOH溶液反应 ④能发生聚合反应 ⑤能发生消去反应 ⑥能与金属钠反应 ⑦能发生取代反应 ⑧能被氧化
| A.①⑤⑦ | B.①②③④⑥⑦⑧ |
| C.⑤ | D.⑤⑧ |
能够鉴定溴乙烷中存在溴元素的实验操作是:
| A.在溴乙烷中直接加入AgNO3溶液 |
| B.加蒸馏水,充分搅拌后,加入AgNO3溶液 |
| C.加入NaOH溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液 |
| D.加入NaOH的乙醇溶液,加热后加入AgNO3溶液 |
某有机物的核磁共振氢谱图如下,该物质可能是: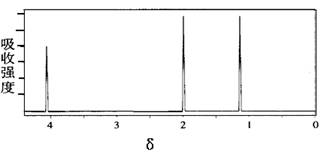
| A.乙酸 | B.苯酚 | C.丙醇 | D.乙酸乙酯 |
已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为:
2CH3CH2Br + 2Na →CH3CH2CH2CH3 + 2NaBr
利用这一反应,下列所给化合物中可以与钠反应合成环丁烷的是:
| A.CH3Br | B.CH2BrCH2CH2CH2Br |
| C.CH2BrCH2Br | D.CH3CH2CH2CH2Br |
由2-溴丙烷为主要原料制取1,2-丙二醇时,需要经过的反应类型是:
| A.加成—消去—取代 | B.消去—加成—取代 |
| C.取代—消去—加成 | D.取代—加成—消去 |