已知常温下在溶液中可发生如下两个离子反应:Ge4++Fe2+===Fe3++Ge3+, Sn2++2Fe3+===2Fe2++Sn4+;由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Sn2+、Fe2+、Ge3+ | B.Sn2+、Ge3+、Fe2+ |
| C.Ge3+、Fe2+、Sn2+ | D.Fe2+、Sn2+、Ge3+ |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
下列叙述正确的是 ( )
A.放出热量关系:a<b<92.4
B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③
D.N2的转化率:②>①>③
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数数值如下:
2NO(g) N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是( )
| A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2) |
| B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 |
| C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2 |
| D.以上说法都不正确 |
某温度时,在体积为1 L的密闭容器中,A、B、C三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,B的体积百分含量与时间关系如图Ⅱ所示。则下列结论正确的是 ( )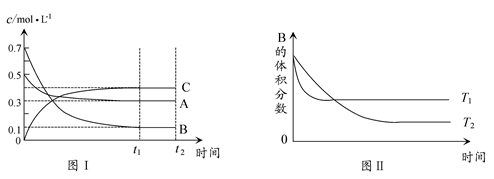
A.该反应的热化学方程式为:A(g )+3B(g) 2C(g) ΔH>0
2C(g) ΔH>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向正反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率增大
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3 kJ·mol-1,且熵减小,在常温常压下该反应能自发进行,对反应的方向起决定作用的是( )
| A.焓变 | B.温度 | C.压强 | D.熵变 |
250°C和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g) ΔH=+56.76 kJ/mol,自发进行的原因是( )
| A.是吸热反应 | B.是放热反应 | C.是熵减反应 | D.熵增效应大于能量效应 |