苹果酸结构如下,常用做汽水、糖果的添加剂。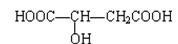
试写出苹果酸分别与下列物质反应的化学方程式:
(1)与Na 。
(2)与Na2CO3 __________________________。
(3)与CH3CH2OH按物质的量比1∶2反应(浓H2SO4,△)_________ __ 。
(14分)FeCl3在选修四中出现的次数较多,可见其重要性.
(1)在演示催化剂对化学反应速率的影响实验中,向H2O2溶液中分别滴入FeCl3溶液和CuSO4溶液,催化效果更好的是________ (1分),画出无催化剂和有催化剂的能量-反应进程对比图,并作必要的文字注明(3分)
(2)在演示增加反应物浓度对化学平衡的影响实验中,稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。将该浅血红色分成两等份,分别加入同浓度的FeCl3溶液和稀KSCN溶液,红色变得更深的是________(1分), 从化学平衡常数的角度加以分析(3分)(温度不变,假设后加入的FeCl3溶液和稀KSCN溶液都是各自起始浓度的10倍)(3分)
(3)分别取若干毫升稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。限用FeCl3、KSCN、 KCl三种化学药品,为证明FeCl3溶液与KSCN溶液的反应是一个可逆反应,至少还要进行()次实验。
| A.1 | B.2 | C.3 | D.4 |
(4)实验室配制和保存FeCl3溶液,要向其中加入________,防止其水解变质。
(5)0.1mol·L-1 FeCl3溶液中的c(Fe3+) 比0.1mol·L-1 (NH4)Fe(SO4)2溶液中的c(Fe3+)______.
.化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种,且均符合勒夏特列原理。
(1)在固定容积的密闭容器中,反应A(g)+2B(g) 4C(g),
4C(g), H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是 __
H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是 __
A.增加B的物质的量 B.加压 C.升温 D.使用催化剂
(2)某溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH) ____c(CH3COOH),混合后溶液中c(CH3COO-)____c(Na+)
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒(不考虑Zn粒对反应速率的影响),反应过程中两溶液的pH变化如下图所示。
则图中表示醋酸溶液中pH变化曲线的是(填A或B)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1m2(选填<﹑=﹑>)
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,
发生如下反应:CO (g) 十H2O (g)  CO2 (g) 十 H2 (g) ; △H<0
CO2 (g) 十 H2 (g) ; △H<0
(1)在850℃时,CO和H2O浓度变化如下左图,则 0~4min的平均反应速率v(CO2)=_mol·L-1·min-1
(2)t1℃时,在相同容器中发生上述反应,各物质的浓度变化如右上表:
① 计算t1℃该反应的平衡常数为K = 。
② t1℃时,反应在5min~6min间,平衡移动(填向左、向右或不 ),若在第5分钟改变一种条件达到第6分钟的浓度,改变的条件是________。
(3)t2℃时,化学反应CO (g) + H2O (g)  CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃850℃,判断依据是:
CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃850℃,判断依据是:
(共15分)下图是实验室制取溴苯的装置。填写以下内容:
(1)写出反应的化学方程式
(2)导管a段的作用。导管b段末端跟锥形瓶里液面保持一段距离的目的是____________________,若锥形瓶内盛硝酸银溶液,图中虚线方框部分的作用
。
(3)反应后不久导管b出口可见到什么现象。
若锥形瓶内盛硝酸银溶液,反应后出现淡黄色,______(填“能”或“不能”)证明苯与溴单质发生取代反应,这是因为___________________________________
(4)反应得到的溴苯呈______色,这是因为;为除去混入溴苯中的溴,可加入_____________试剂,用方法分离。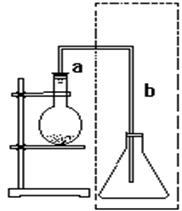
下面各个小题已经给出了化学反应的反应物,试写出完整的化学反应方程式并配平:
(每小题3分,共9分)
乙烯制备聚乙烯:
乙烯和水反应:
苯和硝酸反应: