为测定某有机化合物A的结构,进行如下实验:
(一)分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质中各元素的原子个数比是________。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图1所示质谱图,则其相对分子质量为________,该物质的分子式是________。
(3)根据价键理论,预测A的可能结构并写出结构简式______________________。
(二)结构式的确定:
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(Cl—CH2—O—CH3)有两种氢原子如图2。经测定,有机物A的核磁共振氢谱示意图如图3,则A的结构简式为________。
图1 图2 图3
把煤作为燃料可通过下列两种途径:
途径I: C(s)+O2(g) ="==" CO2(g)
途径II:先制水煤气: C(s) + H2O(g) ="==" CO(g) + H2(g)
燃烧水煤气:2 CO(g) + O2(g)="==" 2CO2(g); 2H2(g)+O2(g) ===2H2O(g)
已知:①C(s)+O2(g)===CO2(g);△H1=-393.5kJ·mol-1
②H2(g)+ O2(g)=H2O(g);△H2=-241.8kJ·mol-1
O2(g)=H2O(g);△H2=-241.8kJ·mol-1
③CO(g)+  O2 (g)=CO2(g);△H3=-283.0kJ·mol-1
O2 (g)=CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)C(煤)的标准燃烧热是
(2)根据盖斯定律写出煤和气态水生成水煤气的热化学方程式:
(3)在制水煤气反应里,反应物具有的总能量________(填“>”、“<”或“=”)生成物所具有的总能量
(4)根据两种途径,下列说法错误的是 (单选)
| A.途径II制水煤气时增加能耗,故途径II的做法不可取 |
| B.与途径I相比,途径II可以减少对环境的污染 |
| C.与途径I相比,途径II可以提高煤的燃烧效率 |
| D.将煤转化为水煤气后,便于通过管道进行运输 |
某同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如下图所示的装置,一次性完成S、C、Si三种元素的非金属性强弱的判断实验。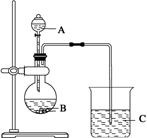
(1)写出A、B、C三处所用的化学药品的名称是:
A_________, B________,C_________。
(2)写出该同学所设计的实验原理所涉及的离子方程式:
①
②
(3)能证明非金属性S>C>Si的实验现象是:
。
A、B、C、D为短周期的主族元素,它们的原子序数依次增大。A和C的原子最外层电子数相等;C+阳离子与Ne原子的电子层结构相同;B、D同主族,B元素原子的最外层电子数是内层电子数的3倍;A与B能形成A2B及A2B2两种化合物,其在常温常压下均呈液态。请回答下列问题:
(1)C2B2中含有的化学键是。
(2)化合物A2B2的电子式是。
(3)A、B、C、D离子半径由大到小的顺序为(用离子符号表示)。
(4)用电子式表示化合物A2B的形成过程:。
下表为元素周期表的一部分,请回答有关问题:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨[ |
⑩ |
(1) ⑤和⑧的元素符号是_________和_________.
(2) 此表中最活泼的金属是_ __(填写元素符号),非金属性最强的元素是__(填写元素符号).
(3)在 ③ ~ ⑦ 元素中,原子半径最大的是 (填写元素符号)。
(4)表中能形成两性氢氧化物的元素是_________(填写元素符号),分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:
________、 ________。
有下列物质:①H2②Na2S2③KOH④HF⑤H2O2⑥MgCl2⑦NH4Cl,按下列要求,用圆圈数字(如:①、②、③等)填空:
(1)只由离子键构成的物质是________;
(2)只由极性键构成的物质是________;
(3)只由非极性键构成的物质是;
(4)只由非金属元素组成的离子化合物是;
(5)由极性键和非极性键构成的物质是___________;
(6)由离子键和极性键构成的物质是_____________;
(7)由离子键和非极性键构成的物质是___________。