【选修5:有机化学基础】
已知有机物A、B、C、D、E、F、G有如下转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为C9H10O2,试回答下列有关问题。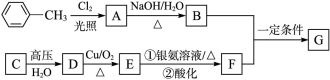
(1)G的名称为 。
(2)指出下列反应的反应类型:A转化为B: ;C转化为D: 。
(3)写出下列反应的化学方程式:
G与足量NaOH溶液反应的化学方程式: 。
(4)符合下列条件的G的同分异构体数目为 种:
①苯环上有3个取代基,且有两个取代基相同;
②能够与新制的银氨溶液反应产生光亮的银镜。
其中核磁共振氢谱有四种不同化学环境的氢的所有物质的结构简式为 、 。
书写下列物质的电子式
HClNH4Cl NaOH
(1)质量数为23,中子数为12的原子的原子结构示意图:
(2)下列物质属于离子晶体,属于分子晶体的是,
原子晶体,金属晶体。
①铁 ②干冰 ③金刚石 ④铜 ⑤水晶 ⑥氯化钠 ⑦碘 ⑧氢氧化钠
利用下列反应:Fe+Cu2+===Fe2++Cu设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解质溶液自选),画出实验装置图,注明电解质溶液的名称和正负极材料,标出电子流动方向和电流方向,写出电极反应式。
利用碳棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当碳棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。试计算:
(1)锌片的质量减少了多少?
(2)原稀硫酸溶液的物质的量浓度。
(3)有多少个电子通过了导线。
下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
 族 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 四 |
⑨ |
⑩ |
⑴在这些元素中,化学性质最不活泼的原子的原子结构示意图为。
⑵地壳中含量最多的金属元素是 。
⑶写出②与④形成的化合物的电子式 。
⑷这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是,呈两性的氢氧化物是。
⑸写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式: 。
⑹写出⑤与氢氧化钠溶液反应的化学方程式:。