高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )。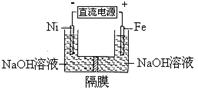
| A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+ |
| B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
危险化学品的包装标签上要印有警示性标志。下列物质选用“腐蚀品”标志的是
| A.汽油 | B.食盐 | C.浓硫酸 | D.炸药 |
人体内所必需的下列元素中,因摄入量不足而导致骨质疏松的是
| A.K | B.Ca | C.Na | D.Fe |
完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl—,消耗等物质的量浓度的AgNO3溶液的体积比为3∶2∶1,则上述溶液的体积比为()
| A.1∶1∶1 | B.3∶2∶1 |
| C.9∶3∶1 | D.6∶3∶2 |
同温同压下,等质量的CO和CO2相比较,下列叙述中正确的是( )
| A.体积比为1∶1 | B.体积比为11∶7 |
| C.原子数比为 2∶3 | D.密度比为11∶7 |
在一定条件下,RO3n-和I-可发生如下反应:RO3n- +6I-+6H+ = R-+ 3I2 +3H2O,则RO3n-中R元素的化合价为:()
| A.+1 | B.+3 | C.+5 | D.+7 |