I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。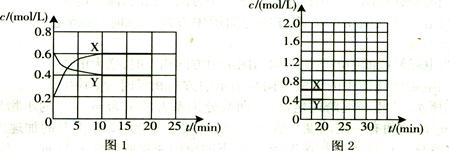
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而改变 |
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为
;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此
时测得c(NO2)="0.9" mol/L。
第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和
“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学
电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示: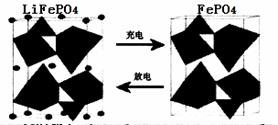
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L.
将33.6L(标况下)乙烯和甲烷混合气体,通入足量的溴水中,充分反应后,水溶液的质量增加了14g。则原混合气体中乙烯与甲烷的体积之比为
写出下列化学方程式(共6分)
(1) 乙炔与氯化氢按物质的量比1:1反应
(2) 苯与浓硝酸、浓硫酸的混合酸共热__________
下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合(氢原子省略)。回答下列问题: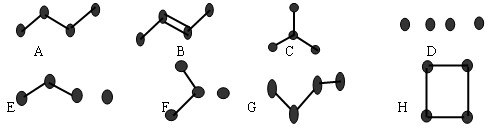
(1)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可
以形成 和 ,还可以形成碳环。
(2)图中属于烯烃的是(填编号)
(3)与A 互为同分异构体的是(填编号)
( 4) 写出上图中B、C、G的结构简式
B 、C 、G .
如图所示,试回答下列问题 (灯泡功率合适):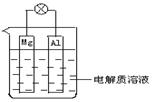
(1)该装置是(填“原电池”或“电解池”.)
(2)电解质溶液为稀H2SO4时,灯泡
(填“亮”或“不亮”,填 “亮”做a题,
填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应为:
Al电极上发生的反应为:
b.若灯泡不亮,其理由为:
(3)电解质溶液为NaOH(aq)时,灯泡
(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极为:极;Al电极为:极(填“正”“负”)
b.若灯泡不亮,其理由为:.
0.15mol某金属单质与足量的稀硫酸充分作用后,在标准状况下生成5.04L氢气和25.65g该金属的硫酸盐,若该金属原子核内的质子数比中子数少1个,试通过计算推导出该元素的原子序数,并指出其在周期表中的位置。