下列说法正确的是
| A.在101kPa下,1g物质完全燃烧所放出的热量叫该物质的热值,单位为kJ•mol-1 |
| B.某放热反应在其它条件不变时,加入催化剂后反应放出的热量会减少 |
| C.一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的 |
D.若一个反应的焓变ΔH=a kJ•mol-1,则其逆反应ΔH= |
在4L密闭容器中充入6molA(g) 和5molB(g) 在一定温度下发生反应:
3A(g)+B(g)  2C(g)+xD(g),达到平衡时,生成2molC ,测得D的浓度为0.5mol/L,则下列判断正确的是
2C(g)+xD(g),达到平衡时,生成2molC ,测得D的浓度为0.5mol/L,则下列判断正确的是
| A.x=1 |
| B.平衡时A的浓度为1.5 mol/L |
| C.B的转化率为20% |
| D.反应起始和达到平衡时,混合气体的压强比为4:5 |
在恒温恒压的密闭容器中投入2molSO2和1molO2,发生反应:2SO2 (g)+O2(g)  2SO3(g)。当达到平衡时,测得SO3体积分数为w% 。现在相同条件下,令a、b、c分别表示起始的SO2、、O2和SO3的物质的量。为达到等效平衡,则下列关于a、b、c的取值正确的是
2SO3(g)。当达到平衡时,测得SO3体积分数为w% 。现在相同条件下,令a、b、c分别表示起始的SO2、、O2和SO3的物质的量。为达到等效平衡,则下列关于a、b、c的取值正确的是
| a |
b |
c |
|
| A |
2 |
1 |
1 |
| B |
1 |
1 |
0 |
| C |
1 |
0 |
1 |
| D |
0 |
1 |
2 |
已知充分燃烧a mol乙炔气体时生成1mol CO2气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
| A.2C2H2(g)+5O2(g)═ 4CO2(g)+2H2O(l)△H="–2b" kJ/mol |
| B.2C2H2(g)+5O2(g)═ 4CO2(g)+2H2O(l)△H="–4b" kJ/mol |
C.C2H2(g)+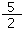 O2(g)═ 2CO2(g)+H2O(l)△H=" +2b" kJ/mol O2(g)═ 2CO2(g)+H2O(l)△H=" +2b" kJ/mol |
D.2C2H2(g)+5O2(g)═ 4CO2(g)+2H2O(l)△H= –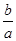 kJ/mol kJ/mol |
下列说法正确的是
| A.需要加热才能发生的反应一定是吸热反应 |
| B.放热反应在常温下一定很容易发生 |
| C.反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对大小 |
| D.在一定条件下,某可逆反应正向是吸热反应,则其逆向必是放热反应 |
室温下,在一个无色透明恒容的密闭容器中存在如下平衡体系:
2NO2(红棕色,g) N2O4 (无色,g)△H<0 。现将该容器浸入冰水中,则正确现象是
N2O4 (无色,g)△H<0 。现将该容器浸入冰水中,则正确现象是
| A.气体颜色变深 | B.气体颜色不变 |
| C.气体颜色变浅 | D.先变深后变浅 |