下列有关叙述中正确的是
| A.难溶于水的电解质一定是弱电解质 |
| B.强电解质在水溶液中的电离过程是不可逆的 |
| C.易溶于水的电解质一定是强电解质 |
| D.强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强 |
将标准状况下的2.24 L CO2通入150 mL 1 mol/L NaOH溶液中,下列说法正确的是
| A.c(HCO3-)略大于c(CO32-) |
| B.c(HCO3-)等于c(CO32-) |
| C.c(Na+)等于c(CO32-)与c(HCO3-)之和 |
| D.c(HCO3-)略小于c(CO32-) |
水是一种极弱的电解质,在室温下水的电离常数为1.8×10-16,若平均每n个水分子只有一个水分子能电离,则n是
| A.1×10-4 | B.55.6×107 | C.1×107 | D.6.02×1021 |
用已知浓度的酸滴定未知浓度的碱时,会导致待测碱液的浓度偏低的操作是
①酸式滴定管用蒸馏水洗后,未用标准液润洗
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③配制碱液时,称量的固体吸潮
④滴定前酸式滴定管尖嘴部分未充满溶液
⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外
| A.①③④ | B.②⑤ | C.②③⑤ | D.①③ |
有人建议用AG表示溶液的酸度(acidity),AG的定义为AG=lg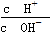 .下列表述正确的是
.下列表述正确的是
| A.在25℃时,若溶液呈中性,则pH=7,AG=1 |
| B.在25℃时,若溶液呈酸性,则pH<7,AG>0 |
| C.在25℃时,若溶液呈碱性,则pH>7,AG<0 |
| D.在25℃时,溶液的pH与AG的换算公式为AG=2×(7-pH) |
某学生用碱式滴定管量取0.1mol·L-1的NaOH溶液,开始时仰视液面读数为1.0mL,取出部分溶液后,俯视液面,读数为11.0mL,该同学在操作中实际取出的液体体积为
| A.大于10.0mL | B.小于10.0mL | C.等于10.0mL | D.等于11.0mL |