对于可逆反应mA(g)+nB(s)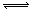 pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图所示,请判断下列说法正确的是
pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图所示,请判断下列说法正确的是
| A.降温,化学平衡向正反应方向移动 |
| B.使用催化剂可使D%有所增加 |
| C.化学方程式中气体的化学计量数m>p+q |
| D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
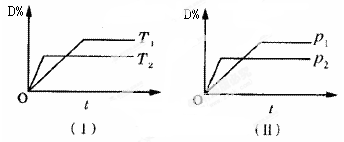
为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。
图(1)
图(2)
(1)请根据甲同学的意图,连接相应的装置,接口顺序:b接__________,__________接__________,__________接a。
(2)U形管中所盛试剂的化学式为______________________________。
(3)装置③中CCl4的作用是__________________________________________________。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在__________之间(填装置序号)。瓶中可以放入__________。
(5)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液。你认为可将溶液换成__________,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
Ⅰ.下列实验操作或对实验事实的叙述正确的是__________(填序号)。
①向试管中滴加液体时,为不使液体滴到试管外应将胶头滴管伸入试管中;
②一小块金属钠加入水中后迅速熔成小球,不停地在水面游动并发出“嘶嘶”的响声;
③配制100 mL 1.00 mol·L-1的NaCl溶液时,可用托盘天平称取5.85 g NaCl固体;
④向可能含有 ,
,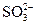 的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验
的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验 的存在;
的存在;
⑤蒸发NaCl溶液,当得到较多NaCl固体时,就停止加热,利用余热蒸干;
⑥向AlCl3溶液中滴加NaOH溶液和向NaOH溶液中滴加AlCl3溶液的现象相同。
Ⅱ.(1)若实验需用6 mol·L-1的盐酸250 mL,配制时除需用量筒、烧杯、玻璃棒外,还需用的仪器有:__________、__________。
(2)实验室利用向氨化后的饱和NaCl溶液中通入过量的CO2来制备NaHCO3晶体,为了分离出NaHCO3晶体,必须用到右图中__________(填序号)装置。
(3)写出生成NaHCO3的化学方程式:______________________________。
对比实验是研究物质性质的一种重要方法,下列不是用来做对比实验的是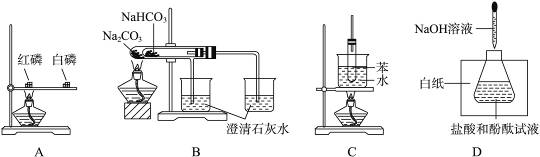
某学习小组做电浮选凝聚法净化污水的实验时,同学们发表了如下看法,其中错误的是
| A.两个电极都可选用Fe片 |
| B.电源电极接反时仍能产生一定净水效果 |
| C.反应中产生的H2会将Fe3+还原成Fe2+ |
| D.电浮选凝聚法用于工业污水处理时要注意通风,防止爆炸 |
由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是
A.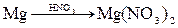 |
B.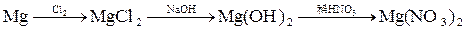 |
C. |
D.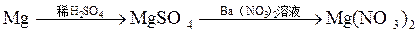 |