有一包“铁”的粉末,可能含有Fe 、Fe2O3 Fe3O4中的一种或几种,现称取23.2g放在试管中,通入足量的一氧化碳并加热充分反应,将生成的气体全部通入足量的澄清石灰水,共得到40g的碳酸钙固体。关于这包“铁” 的粉末成分判断正确的是
| A.一定是纯净物 | B.一定有Fe 、Fe2O3Fe3O4三种 |
| C.如果有Fe ,就一定有Fe2O3 | D.如果有Fe2O3,就一定有Fe3O4 |
下图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是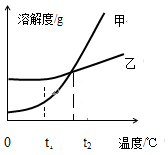
| A.甲物质的溶解度一定大于乙物质的溶解度 |
| B.t2℃时,甲、乙饱和溶液的溶质质量分数相等 |
| C.将甲溶液从t2℃降温到t1℃时,一定有晶体析出 |
| D.将t2℃时乙的饱和溶液变为不饱和溶液,可采用降温的方法 |
下列实验操作中,正确的是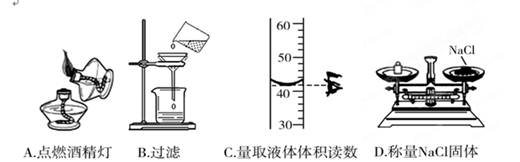
下列实验设计方案合理的是
| A.用碳酸钾和氢氧化镁制备氢氧化钾 |
| B.用氯化钙溶液检验氢氧化钠是否部分变质 |
| C.用氢氧化钡溶液区分硫酸铵、硫酸镁和硫酸钠 |
| D.用氢氧化钠溶液和浓硫酸除去氢气中混有的氯化氢和水蒸气 |
下图为某反应在同一容器中反应前后微粒示意图。下列说法不正确的是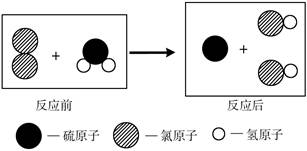
| A.该反应为置换反应 |
| B.该反应的化学方程式为Cl2+H2S=S+2HCl |
| C.化学反应前后分子个数保持不变 |
| D.原子是化学变化中的最小粒子 |
某些金属氢化物与水反应可生成碱和氢气,如:NaH + H2O=NaOH+ H2 ↑。CaH2与足量Na2CO3溶液之间发生反应的产物有
| A.Ca(OH)2 和H2 | B.CaCO3、NaOH和H2 |
| C.NaOH和Ca(OH)2 | D.Ca(OH)2、CaCO3和H2 |