氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25g·L-1。请回答下列问题:
(1)甲与水反应的化学方程式是___________________________________。
(2)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式______________。
有人提出生成的产物Cu中可能还混有Cu2O,请设计实验方案验证之。(已知:Cu2O+2H+=Cu+Cu2++H2O)
______________________________________________。
下列有关实验的叙述中,合理的是
| A.把SO2通入紫色石蕊试液,可验证SO2的漂白性 |
B.构成如图所示装置时,盐桥中的K+向左池移动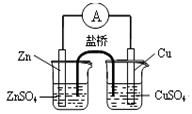 |
| C.配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高 |
| D.将l0 克 ZnSO4·7H2O溶解在90克水中配制10%的ZnSO4溶液 |
下列各溶液中,叙述正确的是
| A.0.1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B.25℃时,将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度的大小关系:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C.将0.1mol/L醋酸溶液加大量水稀释后,溶液的pH增大 |
| D.Na2CO3溶液中:c(Na+ )="2c" (CO32- ) + c (HCO3- ) + c (H2CO3 ) |
下列变化不能用勒夏特列原理解释的是
| A.新制氯水久置后,颜色变浅 |
| B.H2、I2、HI混合气体加压后,颜色变深 |
| C.合成氨时将氨液化分离,可提高原料的利用率 |
| D.向H2S水溶液中加入NaOH,有利于S2-增多 |
用来表示可逆反应2A(g) + B(g) 2C(g) ;△H<0的正确图像为
2C(g) ;△H<0的正确图像为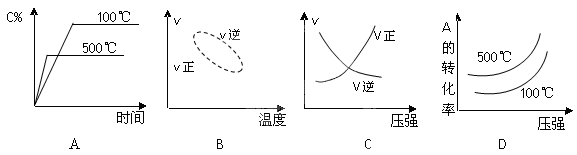
已知某物质X能发生如下转化:
下列有关上述转化关系中物质及其反应的叙述错误的是
| A.若X为N2或NH3(催化氧化),则A为硝酸 |
| B.若X为S 或H2S(完全燃烧),则A为硫酸 |
| C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y |
| D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应 |